KEMIJSKA VEZA: TEORIJA VALENTNE VEZE
Kemijsko-tehnološki fakultet u Splitu
Eni Generalić
Kemijsko-tehnološki fakultet u Splitu
Različite kemijske tvari imaju različite kako kemijske, tako i druge osobine. Osnovni ključ prilikom tumačenja tih osobina je poznavanje i razumijevanje strukture tvari. Početkom XX. stoljeća kemičari su pretpostavljali postojanje valentne veze među atomima u molekuli i prikupili su mnoštvo empirijskih informacija o njoj, međutim zadovoljavajuća teorija koja bi te činjenice objedinila nije postojala. Kada je Schrödinger primijenio kvantno mehaničku teoriju na strukturu vodikovog atoma nije se dugo čekalo da se takav pristup primjeni i na strukturu molekula. Rezultat primjene kvantno-mehaničkog pristupa na kemijsku vezu rezultirao je dvjema teorijama: teorijom valentne veze i teorijom molekularnih orbitala. Prvu je pretežno razvio Linus Pauling, a drugu Robert S. Milliken. Obje teorije unatoč nekim svojim manama dobro opisuju veze u molekulama, a kako se obično ne koriste pri tumačenju istih fenomena, međusobno se nadopunjuju.
Ovdje će biti riječi samo o teoriji valentne veze. Promotrimo sustav od dva odijeljena vodikova atoma A i B, s elektronima e1 (od atoma A) i e2 (od atoma B).
Približavanjem atoma djeluju međusobno jezgre A i B i elektroni e1 i e2 Coulommbovim privlačnim (zelena puna linija) i odbojnim silama (crvena iscrtkana linija):
|
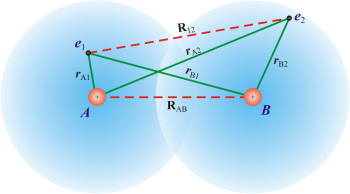 |
Promotrimo sad ovisnost energije sustava o razmaku među jezgrama.

Kako se približavanjem atoma smanjuje razmak među jezgrama A i B, zbog međusobnog privlačenja od a) do d), pada energija sustava. Međutim, daljim smanjivanjem razmaka među jezgrama raste energija sustava zbog međusobnih odbijanja pod e) i f).
Potencijalna energija promatranog sustava ovisna je o tim međudjelovanjima prema izrazu:
gdje je V potencijalna energija a e naboj elektrona, 1.6×10-19 C
Schrödingerova jednadžba primijenjena na molekulu vodika sadrži valnu funkciju koja mora obuhvatiti ponašanje oba elektrona. Približe li se ti atomi toliko da djeluju jedan na drugoga (ali se još uvijek nisu spojili u molekulu vodika), valna funkcija koja obuhvaća ponašanje oba elektrona, kada RAB teži u beskonačnost, jednaka je umnošku njihovih valnih funkcija. Približavanjem atoma dolazi do njihovog spajanja u molekulu i oba elektrona jednako pripadaju obim jezgrama. Više ne možemo govoriti o elektronu e1 koji pripada samo atomu A i elektronu e2 koji pripada samo atomu B. Do smanjenja energije dolazi jer se povećava volumen prostora u kojem se elektroni gibaju čime se smanjuje njihovo međusobno odbijanje. Elektroni nastoje uskladiti svoje gibanje kako bi izbjegli prostor u kojem se nalazi drugi elektron.
Daljnje poboljšanje valne funkcije može se dobiti uzimanjem u obzir međusobnog zasjenjenja elektrona i manje vjerojatnog ionskog karaktera veze, jer se u danom trenutku oba elektrona mogu nalaziti na strani jednog atoma, pa je taj -, a onaj drugi +.
Ukoliko se nacrta graf ovisnosti energije izračunate prema Schrödingerovoj jednadžbi i udaljenosti među jezgrama dvaju vodikovih atoma dobiva se krivulja čiji je minimum određen energijom i duljinom veze.
Teorija valentne veze prvenstveno se koristi za kvalitativnu sliku strukture molekule i veza u njoj a glavne su joj postavke:
- većina elektrona u molekuli ostaje u istim atomskim orbitalama koje su zauzimali dok su atomi bili razdvojeni
- pri nastanku veze po jedna valentna orbitala dvaju atoma što stupaju u vezu međusobno se djelomično preklapaju
- dva elektrona, suprotnog spina, smještaju se u preklopljene orbitale povećavajući gustoću elektronskog oblaka između jezgri
- elektronski par u preklopljenim orbitalama čini vezu i zove se zajednički elektronski par jer na njega djeluju obje jezgre
- na ovaj način među atomima u molekuli nastaje lokalizirana veza koju karakterizira njena jakost, duljina i kut.
Sve dvoatomske i neke jednostavne višeatomske molekule se mogu prikazati jednostavnim preklapanjem atomskih orbitala, dok veze u složenijim molekulama teorija valentne veze objašnjava nastajanjem hibridnih orbitala.
Veza koja nastaje preklapanjem atomskih orbitala duž osi koja povezuje jezgre atoma zove se sigma (σ) veza.

Veza koja nastaje bočnim preklapanjem atomskih orbitala, odnosno iznad i ispod osi koja povezuje jezgre atoma zove se pi (π) veza.

Promotrimo primjenu teorije valentne veze na primjeru molekule sumporovodika.
Molekula sumporovodika sastoji se od jednog atoma sumpora i dva atoma vodika (H2S).

Atom sumpora u svojoj valentnoj ljusci ima šest elektrona raspoređenih u 3s i 3p orbitalama. u 3s ima dva sparena elektrona, a u 3p ima još četiri elektrona, od kojih su dva elektrona sparena, a dva nisu. Dakle, atom sumpora može stupiti u vezu s nesparenim elektronima u dvije međusobno okomite 3py i 3pz orbitale.
Svaki vodikov atom ima pak po jedan nespareni elektron u 1s orbitali. Međusobnim približavanjem vodikovih atoma sumporovom atomu doći će do djelomičnog preklapanja jedne 1s orbitale svakog vodikovih atoma s jednom od 3p orbitala sumporovog atoma s nesparenim elektronima (3py i 3pz). Na ovaj način nastat će po jedna veza sa svakim vodikovim atomom, a kako su p orbitale međusobno okomite onda je i kut među vezama 90°, što odgovara eksperimentalnim podacima.

Hibridne orbitale predstavljaju istovrsne orbitale nastale miješanjem različitih orbitala. Nastajanje hibridnih orbitala može se usporediti s nastajanjem određene nijanse boje iz osnovnih boja. Žuta boja predstavlja s orbitalu a plava p orbitale. Ukoliko pomiješamo jednaki volumen žute i plave boje, odnosno jednu s i jednu p orbitalu, dobit ćemo dvostruki volumen odgovarajuće nijanse zelene boje, odnosno dvije sp hibridne orbitale. Ove hibridne orbitale imaju istu energiju i zovu se energetski degenerirane orbitale.

Kako se teorija valentne veze koristi hibridizacijom pri objašnjenju strukture molekula vidjet ćemo na slijedećim primjerima.
sp-hibridizacija
Strukturnom analizom berilijevog klorida (BeCl2) utvrđeno je da su obje veze iste duljine i jakosti, i da međusobno zatvaraju kut od 180o, odnosno molekula je linearna.


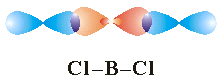
Berilijev atom u svojoj valentnoj ljusci ima dva elektrona u 2s orbitali. Ukoliko mu dovedemo energiju i pobudimo ga, njegovi elektroni iz 2s orbitale će se raspariti i jedan će prijeći u 2px orbitalu. Tako berilijev atom ima na raspolaganju dva nesparena elektrona za vezu s klorovim atomima. Svaki klorov atom ima u svojoj valentnoj ljusci sedam elektrona, dva u 3s i pet u 3p orbitalama, a na raspolaganju im je za stupanje u vezu s berilijevim atomom jedan nespareni elektron u 3p orbitali. Jednostavnim preklapanjem 2s i 3px orbitala berilijeva atoma s po jednom 3p orbitalom svakog atoma klora nikako ne mogu nastati dvije veze iste duljine, a koje još pri tom zatvaraju kut od 180°. Da bi se objasnilo kako nastaju dvije iste veze teorija valentne veze pretpostavlja da je došlo do hibridizacije 2s i 2px orbitala i nastanka dviju degeneriranih sp orbitala, koje su međusobno smještene pod kutom od 180°. Tako sad berilijevom atomu može sa svake strane prići po jedan klorov atom koji će se svaki sa svojom 3pz orbitalom preklopiti s po jednom sp orbitalom berilijevog atoma. Nastat će dvije sigma veze iste duljine (a time i jakosti) pod kutom od 180°, odnosno nastat će linearna molekula.
sp2-hibridizacija
Strukturnom analizom borovog fluorida (BF3) utvrđeno je da se sastoji od tri veze iste duljine i jakosti, koje međusobno zatvaraju kut od 120°, tako da molekula ima oblik istostraničnog trokuta u ravnini.


Borov atom ima u valentnoj ljusci tri elektrona i to dva sparena smještena u 2s orbitali i jedan nespareni u 2px orbitali. Ukoliko mu dovedemo energiju i pobudimo ga njegovi elektroni iz 2s orbitale će se raspariti i jedan će prijeći u 2py orbitalu. Tako borov atom ima na raspolaganju tri nesparena elektrona za vezu s fluorovim atomima. Svaki fluorov atom ima u svojoj valentnoj ljusci sedam elektrona, dva u 2s i pet u 2p orbitalama, a na raspolaganju im je za stupanje u vezu s borovim atomom po jedan nespareni elektron u njihovim 2p orbitalama. Jednostavnim preklapanjem 2s, 2px i 2py orbitala borova atoma s po jednom 2p orbitalom svakog fluorovog atom nikako ne mogu nastati tri veze iste duljine, a koje još pri tom zatvaraju kut od 120°. Da bi se objasnilo kako nastaju tri iste veze teorija valentne veze pretpostavlja da je došlo do hibridizacije 2s, 2px i 2py orbitala i nastanka triju degeneriranih sp2 orbitala, međusobno smještenih pod kutom od 120°. Tako sada borovom atomu može s tri strane prići po jedan fluorov atom koji će se sa svojom 2pz orbitalom preklopiti s po jednom hibridnom sp2 orbitalom borovog atoma. Nastat će tri sigma veze iste duljine (a time i iste jakosti) pod kutom od 120°, odnosno molekula će predstavljati trokut u ravnini.
sp3-hibridizacija
Strukturnom analizom metana (CH4) utvrđeno je da se sastoji od četiri veze iste duljine i jakosti, koje međusobno zatvaraju kut od 109°, tj. usmjerene su prema uglovima tetraedra.


Ugljikov atom ima u valentnoj ljusci četiri elektrona i to dva sparena smještena u 2s orbitali, a preostala dva su nesparena i nalaze se u 2px i 2py orbitali. Ukoliko mu dovedemo energiju i pobudimo ga njegovi elektroni iz 2s orbitale će se raspariti i jedan će prijeći u 2pz orbitalu. Tako ugljikov atom ima sada na raspolaganju četiri nesparena elektrona za vezu s vodikovim atomima. Svaki od četiri vodikova atoma ima pak po jedan nespareni elektron u 1s orbitali. Jednostavnim preklapanjem orbitala ugljikovog atoma (2s, 2px, 2py i 2pz) s 1s orbitalom vodikovog atom nikako ne mogu nastati četiri veze iste duljine, a koje još pri tom zatvaraju kut od 109°. Da bi se objasnilo kako nastaju četiri iste veze, teorija valentne veze pretpostavlja da je došlo do hibridizacije orbitala i nastanka četiri degenerirane sp3 orbitale međusobno smještene pod kutom od 109°, odnosno usmjerenih prema vrhovima tetraedra. Tako sada ugljikovom atomu može s četiri strane prići po jedan vodikov atom čija će se 1s orbitala preklopiti s jednom hibridnom sp3 orbitalom ugljikovog atoma. Nastat će četiri sigma veze iste duljine (a time i iste jakosti) pod kutom od 109°, odnosno molekula će imati tetraedarsku strukturu.
U slijedećoj tablici su dati primjeri mogućih hibridizacija kojima se teorija valentne veze služi prilikom tumačenja strukture složenih molekula. Pri tom tumačenju potrebno je imati na umu slijedeće činjenice:
- hibridizacija je miješanje najmanje dviju različitih atomskih orbitala
- hibridizirati se mogu samo one orbitale koje se malo razlikuju u energiji
- broj nastalih hibridnih orbitala jednak je broju atomskih orbitala iz kojih su nastale
- hibridizacija zahtjeva dodatnu energiju koju sustav vrati nakon nastajanja veze
- hibridizacija se nikad ne primjenjuje na izolirani atom, koristi se samo za objašnjenje postojeće strukture molekule
| Tip hibridizacije | Broj energijski istih veza | Razmještaj veza |
|---|---|---|
| sp-hibridizacija | 2 | pravac |
| sp2-hibridizacija | 3 | trokut |
| sp3-hibridizacija | 4 | tetraedar |
| dsp2-hibridizacija | 4 | kvadrat |
| dsp3-hibridizacija | 5 | trigonska bipiramida |
| d2sp3-hibridizacija | 6 | oktaedar |
| d4sp3-hibridizacija | 8 | dodekaedar |
Stvaranje višestruke veze
Teorijom valentne veze jednostavno se tumači i višestruka veza koja može nastati između atoma u molekuli. Ovisno o broju zajedničkih elektronskih parova između dva atoma u molekuli veza može biti jednostruka, dvostruka i trostruka. Povećanjem broja veza jakost veze raste a duljina veze opada, što možemo vidjeti na primjeru veza između dva ugljikova atoma:
| Vrsta veze | Duljina veze /pm | Jakost veze /(kJ/mol) |
|---|---|---|
| jednostruka | 143 | 346 |
| dvostruka | 122 | 602 |
| trostruka | 113 | 835 |
Prema teoriji valentne veze kod višestruke veze (dvostruke ili trostruke) samo je jedna sigma veza, dok su ostale pi. Pri tom ako centralni atom iz druge periode čini dvostruku vezu primjenjuje se sp2-hibridizacija, a ako centralni atom iz druge periode čini dvije dvostruke veze ili jednu trostruku primjenjuje se sp-hibridizacija. Pogledajmo to na primjeru etena i etina.
Dvostruka veza
U molekuli etena (C2H4) ugljikovi atomi su međusobno povezani dvostrukom vezom.


Svaki ugljikov atom formira tri sp2 hibridne orbitale koje leže u istoj ravnini pod kutom od 120°. Po dva od njih daju preklapanjem s 1s orbitalama četiri vodikova atoma četiri sigma veze. Preostala dvije sp2 hibridne orbitale od oba ugljikova atoma čine primarnu sigma vezu. Time dolazi do tolikog približavanja ugljikovih atoma da se preklope i preostale dvije p orbitale (koje su okomite na ravninu sp2 hibridnih orbitala) i nastane dodatna pi veza. Primarna sigma veza je jača od sekundarne pi veze, zbog čega molekula etena lako adira druge atome pucanjem pi veze.
Trostruka veza
U molekuli etina (C2H2) ugljikovi atomi su međusobno povezani trostrukom vezom.


Trostruka veza sastoji se od jedne sigma veze i dviju pi veza. Svaki ugljikov atom koristi se dvjema hibridnim sp orbitalama za stvaranje dviju sigma veza, a preostale p orbitale tvore dvije pi veze. Po jedna od dvaju sp hibridnih orbitala svakog ugljikovog atoma daje preklapanjem s 1s orbitalom vodika jednu sigma vezu. Preostale dvije sp orbitale tvore međusobnim preklapanjem sigma vezu među ugljikovim atomima, tako dovedu ugljikove atome dovoljno blizu jedan drugome da se međusobno preklope p orbitale (koje su okomite su na dvije hibridne sp orbitale) svakog ugljikovog atoma čime nastanu dvije dodatne pi veze među ugljikovim atomima. Molekula etina je jako reaktivna, pri čemu trostruka veza među ugljikovim atomima prelazi u dvostruku ili jednostruku.
Da ponovimo,
- teorija valentne veze počiva na kvantno mehaničkom pristupu
- spajanjem atoma u molekulu postiže se energetski stabilniji sustav, pri čemu atomi prelaze u drugačije elektronske konfiguracije stvaranjem zajedničkog elektronskog para
- atomi u molekuli zadržavaju svoju osobnost
- valentni elektroni služe za vezivanje atoma, a unutarnji elektroni ne sudjeluju u kemijskoj vezi
- pretežno se koristi za tumačenje geometrije molekula pri čemu se oslanja na koncept hibridizacije
I skoro smo zaboravili odakle potječe i što znači riječ valencija
Valencija (lat. valentia = moć, kapacitet) je svojstvo atoma nekog elementa da se spaja s atomima drugog ili istog elementa
Literatura:
- I. Filipović, S. Lipanović, Opća i anorganska kemija I. dio, Školska knjiga, Zagreb, 1995.
- J. W. Hill, R. H. Petrucci, General Chemistry, Prentice-Hall, New Jersey, 2002.
- R. J. Gillespie, P. L. A. Popelier: Chemical bonding and molecular geometry, Oxford University Press,New York Oxford, 2001.
- L. Pauling, The nature of the chemical bond, Cornell University press, Ithaca, New York, 1960.
Citiranje ove stranice:
Generalić, Eni. "Kemijska veza: Teorija valentne veze." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/enig/kemijska_veza_teorija_valentne_veze.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
