POLAROGRAFIJA
Kemijsko-tehnološki fakultet u Splitu
Polarografija je voltametrijska tehnika koja se temelji na difuzijom kontroliranom putovanju analita do površine kapajuće živine elektrode, KŽE ili DME (en. Dropping Mercury Electrode). Depolarizacijski potencijal omogućava identifikaciju iona prisutnih u otopini (depolarizatora), a mjerenjem difuzijske struje može se izračunati njihova koncentracija.
Polarografska analiza temelji se na pojavama polarizacije i depolarizacije pri elektrolizi. Do polarizacije ne dolazi kad je jakost struje slaba a površina elektrode velika - potencijal takve elektrode za vrijeme elektrolize ostaje konstantan. Međutim, kad imamo jako malu površinu elektrode, unatoč maloj jakosti struje gustoća struje na takvoj elektrodi je velika, te se takva elektroda lako polarizira, tj. njen se potencijal mijenja s promjenom vanjskog polarizirajućeg napona.
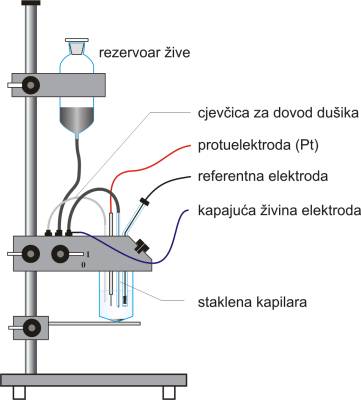
Češki kemičar Jaroslav Heyrovský (1890.-1967.) je 1922. godine utvrdio da se ponovljivi rezultati mogu dobiti ako se kao polarizirajuća elektroda upotrijebe sitne kapi žive koje kapaju s kapilare (promjera oko 0.05 mm). Kao nepolarizirajuću elektrodu Heyrovský je upotrijebio živu koja se skupljala na dnu posude. Budući da je površina žive na dnu posude (anoda) mnogo veća od površine pojedinih kapi žive (katoda) primijenjena EMS polarizacije predstavlja u stvari samo potencijal kapajuće živine elektrode.
Kapajuća živina elektroda
Kod klasične polarografije kapajuća živina elektroda nalazi se u nemiješajućoj sredini a narinuti potencijal, u odnosu na referentnu elektrodu, linearno se mijenja. Upotrebom neprekidno obnavljane površine žive katodni proces uvijek teče na čistoj površini konstantnog sastava. Kod stacionarne živine elektrode, površina metala se progresivno mijenja (amalgamiranjem, oksidacijom, i sl.). Kako pojedina kap raste struja također raste, te naglo pada kada se kap otkine s vrha kapilare. Amplituda periodičnih fluktuacija struje može se smanjiti prigušnim otporima ili kondenzatorima.
Zbog male površine radne elektrode i jakost struje koja prolazi kroz sustav je slaba, i zbog toga se, kod kratkotrajne elektrolize, praktički ne mijenja koncentracija elektrolizirane otopine kada je njen volumen veći od 1 cm3. Optimalne koncentracije depolarizatora, bez obzira je li riječ o kvalitativnoj ili kvantitativnoj polarografskoj analizi, kreću se od 10-2 mol/dm3 do 10-4 mol/dm3 s pogreškom mjerenja koja ne prelazi 2 %.
Prikažemo li rezultate tako da je napon na apscisi (x-os) a jakost struje na ordinati (y-os), dobit ćemo karakterističnu zupčastu krivulju koja prikazuje odnos između napona na elektrodama i jakosti struje, tzv. krivulju struja-napon. Budući da je takva krivulja uzrokovana pojavama polarizacije na kapajućoj živinoj elektrodi, Heyrovský ju je nazvao polarogramom, a njen stepenasti dio polarografskom stepenicom ili polarografskim valom.
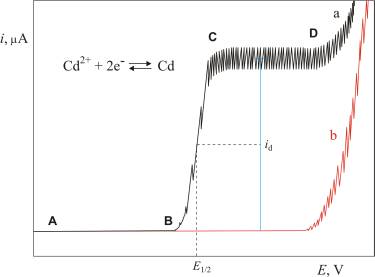
Takav polarogram za kadmijev ion (Cd2+) u klorovodičnoj kiselini kao osnovnom elektrolitu, prikazan je na Slici 2. Struja koja teče u intervalu od A do B predstavlja osnovnu struju. Dio krivulje od B do C odgovara pravoj Faradayevoj struji kada zbog reakcije na površini elektrode kroz otopinu počinje teći struja. Kapajuća živina elektroda depolarizirala se elektrodnom reakcijom
Difuzijom se kadmijevi ioni prenose iz otopine do elektrode. Uzrok difuziji je razlika koncentracija koja nastaje zbog redukcije elektroaktivne vrste na elektrodi uslijed čega dolazi do iscrpljivanja otopine uz elektrodu. Za svaki primijenjeni napon na elektrodi uspostavlja se ravnoteža kod koje je broj iona koji se reduciraju jednak broju iona koji se difuzijom prenesu na elektrodu. Povećanjem napona, otopina uz elektrodu se sve više iscrpljuje što uvjetuje bržu difuziju, zbog veće razlike koncentracija, a time i jaču struju. Na kraju se koncentracija Cd2+ iona uz katodu toliko smanji da praktično postane jednaka nuli.
Daljnjim povećanjem napona ta se koncentracija više ne može smanjiti, pa zbog toga difuzija i struja koja je njome određena ostaju konstantne (interval od C do D). Tu konstantnu struju nazivamo graničnom strujom. Kako je granična struja određena samo brzinom difuzije iona prema elektrodi, nazivamo je difuzijskom strujom.
Polarogram (b) na Slici 2. prikazuje vrijednosti dobivene korištenjem samog osnovnog elektrolita HCl. Rezidualna struja koja se pojavljuje u odsutnosti Cd2+ iona može se koristiti kao osnovna linija za mjerenje difuzijske struje kao što je prikazano na Slici 2.
Jednadžba polarografskog vala
Iz visine polarografskog vala najjednostavnije je odrediti koncentraciju depolarizatora kada je visina polarografskog vala tj. granična struja izravno proporcionalna koncentraciji depolarizatora. Granična struja (ig), ovisi o tri faktora:
- difuzijske struje (id)
- migracijske struje (im)
- adsorpcijske struje (ia)
Migracijska struja nastaje kao rezultat kretanja iona pod utjecajem električnog polja. Da bi se migracijska struja uklonila ili znatno smanjila, u otopinu se dodaje veliki suvišak neaktivnog elektrolita (osnovni elektrolit), čiji je potencijal redukcije mnogo negativniji od potencijala određivanog iona.
Adsorpcijska struja, nastala zbog adsorpcijskih i elektrokinetičkih sila na površini kapajuće živine elektrode, eliminira se dodatkom kapilarnoaktivnih tvari koje se adsorbiraju na površini elektrode i blokiraju djelovanje adsorpcijskih sila.
Nalazi li se, dakle, u otopini depolarizatora osnovni elektrolit i pogodna kapilarnoaktivna tvar granična struja je jednaka difuzijskoj struji i vrijedi odnos:
Kod polarografskih mjerenja otopinu ne miješamo (nema konvekcije) a kako je dodana veća količina inertnog elektrolita (da spriječi migraciju iona pod utjecajem električnog polja) transport ispitivanih iona vrši se uglavnom samo difuzijom. Slovački fizičar Dionýz Ilkovič (1907.-1980.) je, primjenom Fickovih zakona difuzije, izveo jednadžbu difuzijske struje na kapajućoj živinoj elektrodi:
Konstanta, k, Ilkovičeve jednadžbe iznosi 708 za maksimalnu a 607 za prosječnu graničnu struju. Iz Ilkovičeve jednadžbe vidimo da veličina difuzijske struje, id, (µA), ovisi o:
- koncentraciji depolarizatora, c, (mmol/dm3)
- prirodi depolarizatora - broju izmijenjenih elektrona na elektrodi, n, i koeficijentu difuzije depolarizatora, D, (cm2/s)
- karakteristikama kapilare kapajuće elektrode - brzini istjecanja žive, m, (mg/s) i vremenu kapanja, t, (s)
Ilkovičevom jednadžbom za difuzijsku struju definirana je samo difuzijska struja koja je posljedica redukcije ili oksidacije depolarizatora na kapajućoj živinoj elektrodi.
Cjelokupna krivulja struja-napon određena je odnosom između potencijala elektrode i odgovarajuće jakosti struje. Heyrovský i Ilkovič izveli su jednadžbu kojom je dana strujno- naponska ovisnost za reverzibilne sustave:
Grafičko određivanje difuzijske struje i poluvalnog potencijala
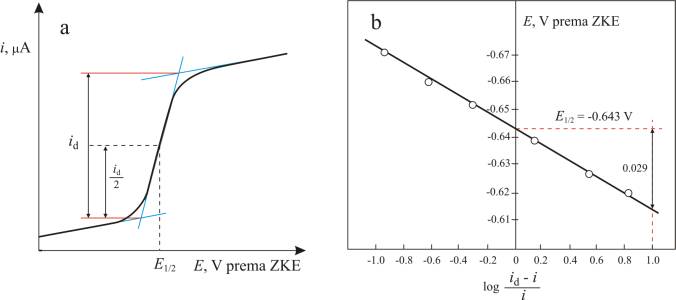
Da bi se dobila prava difuzijska struja, proporcionalna koncentraciji, mora se izvršiti korekcija za predstruju koja protječe kroz ćeliju prije nego se dostigne potencijal izlučivanja. Grafički se difuzijska struja određuje tako da se na sva tri dijela vala (Slika 3.a) povuku tangente. Vertikalni razmak između sjecišta tangenti predstavlja korigiranu visinu polarografskog vala. Kako su metode mjerenja visine polarografskog vala većinom empirijskog karaktera, u kvantitativnoj polarografskoj analizi uvijek se mora upotrijebiti ona metoda koja je upotrijebljena kod baždarenja otopinom poznate koncentracije.
Poluvalni potencijal, E½, je potencijal karakterističan za svaki pojedini ion i jednak je potencijalu na kojem je struja jednaka polovici granične difuzijske struje (id = id/2). Kod reverzibilnih sustava E½ neovisan je o koncentraciji depolarizatora (ali ovisi o sastavu otopine) pa se E½ može koristiti za kvalitativno određivanje elektroaktivnih vrsta. Vrijednosti poluvalnih potencijala za neke ione možete naći na na kraju teksta.
Grafički se poluvalni potencijal određuje tako da se povuče pravac, paralelan s apscisom, kroz sredinu razmaka između sjecišta tangenti. Na mjestu gdje pravac siječe val spusti se okomica na apscisu i očita E½.
Iz dobivene i - E krivulje može se pomoću jednadžbe 2. odrediti E½ i n nekog depolarizatora. Na dijelu stvaranja polarografskog vala odredi se pri različitim potencijalima, E, jakost struje, i, a zatim izračuna log[(id-i)/i]. Nanesemo li u koordinatni sustav E kao ordinatu, a log[(id-i)/i] kao apscisu, dobivamo pravac (Slika 3.b) čiji je nagib jednak
Vrijednost za n može se izračunati iz nagiba pravca ako su procesi na elektrodi reverzibilni. Vrijednost E½ očita se iz grafa u točki u kojoj pravac siječe ordinatu.
Smetnje pri snimanju polarograma
Elektrokapilarnost žive
Tijekom mjerenja vrijeme kapanja KŽE varira zbog promjene površinske napetosti živine kapi. Potencijal na kojem je vrijeme kapanja najduže nalazi se kod elektrokapilarnog maksimuma. Elektrokapilarnost žive je pojava da površinski napon žive (odnosno volumen, koji je utoliko manji što je napetost površine veća) ovisi o narinutom potencijalu.
Utjecaj kisika
Otopljeni kisik daje dvostruki polarografski val i samim time smeta kod određivanja drugih depolarizatora. Prvi val odgovara redukciji O2 do H2O2 uz prijelaz od 2e-, a kod drugog vala dolazi do prijelaza od 4e- i nastajanja H2O. Uklanjanje otopljenog kisika iz ispitivane otopine može se izvršiti propuhivanjem otopine s nekim inertnim plinom (N2, H2, CO2).
Rezidualna struja
Otopine i najčišćih osnovnih elektrolita iz kojih je uklonjen kisik pokazuju ipak malu rezidualnu struju. Ona raste gotovo linearno s porastom potencijala kapajuće živine elektrode i prouzročena je redukcijom tragova nečistoća u otopini (osnovna struja) i stvaranjem i neprestanim obnavljanjem električnog dvosloja na površini živine kapi (kondenzatorska struja). Kondenzatorsku odnosno kapacitetnu struju ne možemo izbjeći tokom polarografskog mjerenja.
Polarografski maksimumi
Ukoliko se ne poduzmu posebne mjere, može doći do pojava nepravilnosti na polarografskim valovima, koje se nazivaju polarografskim maksimumi. Pojava maksimuma deformira normalni oblik vala, pa otežava precizno određivanje difuzijske struje. Uzrok pojavi maksimuma je lokalno miješanje otopine koje se javlja u neposrednoj blizini kapi koja raste, što povećava difuzijsku struju.
Polarografski maksimumi su osjetljivi na prisustvo vrlo malih količina površinski aktivnih tvari. Kao depresor maksimuma vrlo često se upotrebljava želatina, agar, ksiloza ili metil-crveno.
Aparatura za polarografsku analizu
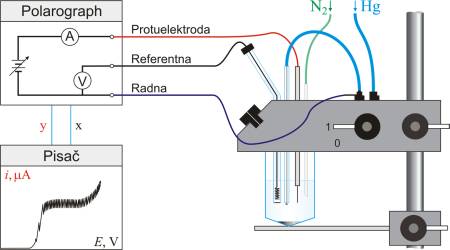
Aparatura za polarografska mjerenja koja se koristi u laboratoriju prikazana je na Slici 4. Polarograf (potenciostat) snima potencijal narinut na ćeliju, mjeri rezultirajuću struju i prikazuje je na pisaču. Najvažniji dio polarografske ćelije je kapajuća živina elektroda. Živa se gravitacijom tlači kroz finu kapilaru da bi se dobila kontinuirana struja identičnih kapi, od kojih svaka ima promjer između 0.5 mm i 1 mm. Svaka kapljica raste dok ne postane preteška da visi nakon čega se otrgne i otpadne s kapilare. Vrijeme "života" svake kapi je obično od 4 do 6 sekundi. Aktualno vrijeme padanja kapi određeno je protokom žive kroz kapilaru što se može podešavati pomicanjem spremnika žive. Podizanjem spremnika protok žive je veći a vrijeme kapanja kraće.
Kao referentna elektroda obično se koristi zasićena kalomel (ZKE) ili Ag/AgCl elektroda. Platinska žica služi kao protuelektroda. Propuhivanje inertnog plina (dušika ili argona) vrši se staklenom cjevčicom s uskim završetkom čime se postiže da plin u malim mjehurićima brzo istjera kisik iz otopine. Polarografska ćelija može biti i obična staklena čaša zatvorena gumenim čepom s rupama za kapilaru, referentnu elektrodu, protuelektrodu i cjevčicu za propuhivanje dušikom.
Upozorenja
Ne smije se nikada dopustiti da KŽE bude u otopini ako nije omogućen protok žive jer će čak i tragovi nečistoća uzrokovati nepouzdanost rada kapilare, ili potpunu zakrčenost kapilare. Prije nego bilo koja otopina ili čak čista voda dođe u kontakt s KŽE, treba provjeriti da li živa ističe iz kapilare. Poslije upotrebe treba KŽE izvaditi iz ćelije i dok živa još istječe na vrhu, kapilaru treba dobro oprati mlazom destilirane vode. Elektrode se osuše i tek nakon toga se spremnik žive spusti (ne ranije). Elektroda se ostavi na zraku a prazna ćelija se podigne oko elektrode da je zaštiti od laboratorijskih isparavanja i prašine.
Zagađenje ćelije tragovima materijala od prethodnih mjerenja može uzrokovati ozbiljne pogreške. Ćelija se skine i pažljivo ispere mlazom destilirane vode, izbaci vani isprani sadržaj i ponovi procedura nekoliko puta. Također se mora paziti da se ćelija ne napuni ispitivanom otopinom dok je još mokra. Kod ispitivanja niza otopina greška se može smanjiti ako se ispitivanje vrši od otopina nižih koncentracija ka većim.
Temperatura ćelije mora biti konstantna, 25 ± 0.5 °C, a poželjno je i manje odstupanje. Temperatura utječe, prije svega, na vrijednost koeficijenta difuzije depolarizatora i njen utjecaj, u intervalu od 20 do 50 °C, iznosi od 1.3 do 2.3 % po supnju. Termostat treba održavati temperaturu od ± 0.5 °C ako želimo raditi s greškom manjom od 1 %, ali ako ga nemamo, najbolji rezultati postižu se snimanjem kalibracijske krivulje i nepoznate isti dan.
PARE ŽIVE SU VRLO OTROVNE. Otpadna živa mora se pohraniti u spremnik i odmah zaštiti od istjecanja. Odmah prijaviti svako istjecanje žive.
Poluvalni potencijali odabranih elemenata
Potencijali u tablici dani su u odnosu na zasićenu kalomel elektrodu pa, ukoliko radite s Ag/AgCl referentnom elektrodom ili nekom drugom koncentracijom KCl, možete u tablici ovisnosti potencijala referentnih elektroda o temperaturi i koncentraciji KCl pronaći njihove odnose.
| Element | Elektrodna reakcija | Pomoćni elektrolit | E1/2 ZKE (V) |
|---|---|---|---|
| Ag | Ag+ → Ag | K[Ag(CN)2] | -0.3 |
| Al | Al3+ → Al | 0.05 mol/dm3 BaCl2 | -1.75 |
| Cd | Cd2+ → Cd | 0.1 mol/dm3 KCl + 0.01 % želatina | -0.6 |
| Cd2+ → Cd | 1 mol/dm3 HCl + 0.01 % želatina | -0.64 | |
| Cd2+ → Cd | 0.5 mol/dm3 NaNO3 + 0.01 % želatina | -0.64 | |
| Cd2+ → Cd | 1 mol/dm3 NH3 + 1 mol/dm3 NH4Cl + 0.01 % želatina | -0.81 | |
| Cd2+ → Cd | 1 mol/dm3 KCN | -1.18 | |
| Cu | Cu2+ → Cu | 1 mol/dm3 NaOH + 0.01 % želatina | -0.42 |
| Cu+ → Cu | 0.5 mol/dm3 NaNO3 + 0.01 % želatina | -0.12 | |
| Cu+ → Cu | 1 mol/dm3 NH3 + 1 mol/dm3 NH4Cl | -0.50 | |
| Cu2+ → Cu | 0.1 mol/dm3 KSCN | -0.02 | |
| Fe | Fe3+ → Fe2+ | 0.2 mol/dm3 Na2C2O4 + 0.005 % želatina | -0.25 |
| Fe2+ → Fe | 1 mol/dm3 NaOH | -1.46 | |
| Fe3+ → Fe2+ | 1 mol/dm3 (NH4)2CO3 | -0.44 | |
| Fe2+ → Fe | 1 mol/dm3 (NH4)2CO3 | 1.52 | |
| Ni | Ni2+ → Ni | 0.01 mol/dm3 KCl | -1.1 |
| Ni2+ → Ni | 1 mol/dm3 KSCN | -0.70 | |
| Ni2+ → Ni | 1 mol/dm3 NH3 + 1 mol/dm3 NH4Cl | -1.09 | |
| Ni2+ → Ni | 1 mol/dm3 KCN + 0.01 % želatina | -1.36 | |
| O2 | O2 → H2O2 | 0.1 mol/dm3 HCl ili KCl, ili NaOH | -0.1 |
| H2O2 | H2O2 → H2O | 0.1 mol/dm3 HCl, ili KCl | -0.90 |
| Pb | Pb2+ → Pb | 0.1 mol/dm3 KCl + 0.01 % želatina | -0.40 |
| Pb2+ → Pb | 1 mol/dm3 HNO3 + 0.01 % želatina | -0.40 | |
| Pb2+ → Pb | 1 mol/dm3 NaOH + 0.01 % želatina | -0.76 | |
| Pb2+ → Pb | 0.5 mol/dm3 NaNO3 | -0.50 | |
| Pb2+ → Pb | 1 mol/dm3 KCN | -0.72 | |
| Sn | Sn2+ → Sn | 1 mol/dm3 HCl + 0.01 % želatina | -0.47 |
| Sn2+ → Sn | 1 mol/dm3NaOH + 0.01 % želatina | -1.22 | |
| Sn2+ → Sn4+ | 1 mol/dm3NaOH + 0.01 % želatina | -0.73 | |
| Sn2+ → Sn | 0.5 mol/dm3 NaNO3 + 0.1 mol/dm3 NaOH + 0.01 % želatina | -0.71 | |
| Sn2+ → Sn4+ | 0.5 mol/dm3 NaNO3 + 0.1 mol/dm3 NaOH + 0.01 % želatina | -1.16 | |
| Sn4+ → Sn | 2 mol/dm3 HClO4 + 0.5 mol/dm3 HCl | -0.47 | |
| Sn2+ → Sn4+ | zasićena otopina vinske kiseline | -0.50 | |
| Zn | Zn2+ → Zn | 0.1 mol/dm3 KCl + 0.01 % želatina | -1.0 |
| Zn2+ → Zn | 1 mol/dm3NaOH + 0.01 % želatina | -1.53 | |
| Zn2+ → Zn | 0.5 mol/dm3 NaNO3 + 0.01% želatina | -1.14 | |
| Zn2+ → Zn | 0.1 mol/dm3 KSCN | -1.01 | |
| Zn2+ → Zn | 1 mol/dm3 KNO3 | -1.01 |
Literatura
- Uputstvo za upotrebu Polarografa MA 5450, Iskra Merilna elektronika Horjul, Horjul, 1986.
- I. Filipović, P. Sabioncello, Laboratorijski priručnik, I. dio - knjiga druga, Tehnička knjiga, Zagreb 1960.
- D.T. Sawyer, W.R. Heineman, J.M. Beebe, Chemistry Experiments for Instrumental Methods, John Wiley & Sons, New York, 1984.
- R.G. Bates, Treatise on Analytical Chemistry, I.M. Kolthoff and P. J. Elving, Eds., Part I, Vol. 1, New York, 1959
- D.T. Sawyer and J. L. Roberts Jr., Experimental Electrochemistry for Chemists, Wiley, New York, 1974.
Citiranje ove stranice:
Generalić, Eni. "Polarografija." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/enig/polarografija.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni