POTENCIOMETRIJSKI SENZORI
Kemijsko-tehnološki fakultet u Splitu
Eni Generalić
Kemijsko-tehnološki fakultet u Splitu
Opća načela
Potenciometrija je elektroanalitička metoda u kojoj se mjeri razlika potencijala između elektroda elektrokemijske ćelije uz ravnotežne uvijete. Mjerenje napona ćelije provodi se tako da kroz ćeliju ne teče struja, odnosno teče tako malena električna struja da ne utječe mjerljivo na stanje ravnoteže na elektrodama.
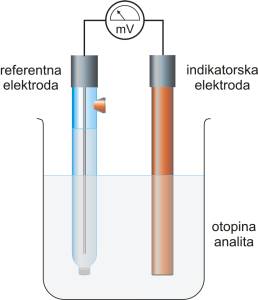
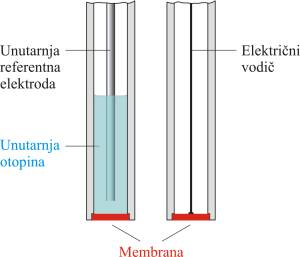
Kako se eksperimentalno ne mogu odrediti apsolutne vrijednosti pojedinačnih potencijala polučlanka, određuju se naponi članka. Što je elektrokemijski članak? Jednostavno rečeno elektrokemijski članak se sastoji od dva vodiča, koji se nazivaju elektrodama, uronjena u otopinu elektrolita.
U većini slučajeva elektrode su uronjene u različite otopine da se spriječi njihovo miješanje, a elektricitet se iz jedne otopine u drugu provodi elektrolitnim mostom (elektrolitni most je vodljiva otopina). Jedan jednostavni članak se može opisati na slijedeći način:
referentna elektroda | elektrolitni most | otopina analita | indikatorska elektroda
Referentna elektroda ima točno poznat elektrodni potencijal (Eref) koji ne ovisi o koncentraciji analita niti o koncentraciji drugih iona u otopini
Indikatorska elektroda razvija potencijal (Eind) koji ovisi o aktivitetu analita. Većina indikatorskih elektroda koje se koriste u potenciometriji daje visoko selektivan odziv na ispitivane ione.
Kontaktni potencijal (E kon) nastaje na granici između dviju tekućina koje stvaraju elektrolitni most.
Napon članka može se prikazati jednadžbom:
Ečlanka = Eind - Eref + Ekon.
Pri izvođenju potenciometrijske analize potrebno je izmjeriti napon članka, korigirati ga za potencijal referentne elektrode i kontaktni potencijal te iz potencijala indikatorske elektrode izračunati koncentraciju analita.
Referentne elektrode
Referentna elektroda jest elektroda čiji je potencijal poznat i potpuno neovisan o koncentraciji analita. Idealna referentna elektroda
- mora imati poznat i stalan potencijal, neovisan o sastavu otopine
- mora biti jednostavne izvedbe
- pri prolazu malih struja potencijal se ne smije mijenjati
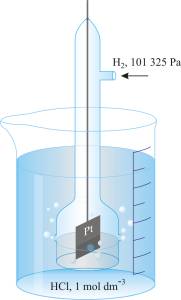
Standardna vodikova elektroda univerzalna je referentna elektroda prema kojoj se iskazuju potencijali svih ostalih elektroda. Sastoji se od pločice platinirane platine (spužvaste platine) uronjene u otopinu vodikovih iona aktiviteta 1 kroz koju se propušta plinoviti vodik pod tlakom od 101 325 Pa. Standardni elektrodni potencijal neke elektrode definira se kao standardna elektromotorna sila članka u kojoj je jedna od elektroda standardna vodikova elektroda. Elektrodni potencijal po definiciji je redukcijski potencijal.
Standardna vodikova elektroda
Pt|H2(a = 1)|H+(a = 1)
Elektrodna reakcija u polučlanku je:
2H+(aq) + 2e- ![]() H2(g)
H2(g)
a potencijal se može prikazati
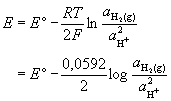
Redoks-potencijal standardne vodikove elektrode, pri svim temperaturama, dogovorno je uzet kao 0.
Zbog zahtjevnosti održavanja standardna vodikova elektroda se zamjenjuje sa sekundarnim referentnim elektrodama čiji su potencijali određeni u odnosu prema vodikovoj elektrodi. Kao referentne elektrode najčešće se koriste kalomel i srebro/srebrov klorid elektroda.
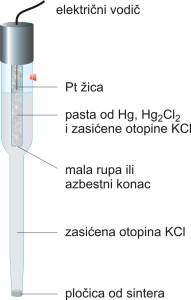
Kalomel elektroda se najčešće upotrebljava kao referentna elektroda u laboratoriju, jer ju je lako pripremiti tako da ima točno poznat potencijal. U unutrašnjoj cijevi nalazi se pasta od žive, kalomela (kalomel je trivijalno ime za živin(I) klorid, Hg2Cl2) i otopine kalijeva klorida u koju je uronjena platinska žica. Ta je pasta s otopinom kalijeva klorida u vanjskoj cijevi spojena pomoću malog otvora na dnu. Veza s otopinom analita ostvaruje se preko sinterirane pločice, poroznog stakla ili porozne vlaknaste brtve.
Kalomel elektroda
Hg|Hg2Cl2(zas), KCl(x))
gdje je x koncentracija KCl u otopini.
Elektrodna reakcija u polučlanku je:
Hg2Cl2(s) + 2e- ![]() 2Hg(l) +2Cl-
2Hg(l) +2Cl-
a potencijal se može prikazati
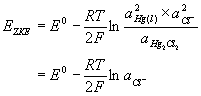
Zasićena kalomel elektroda (ZKE) ima standardni potencijal 0.244 V pri 25 °C. Nedostatak ove elektrode je njen veliki temperaturni koeficijent što je potrebno uzeti u obzir ako tijekom mjerenja dolazi do većih promjena temperature.
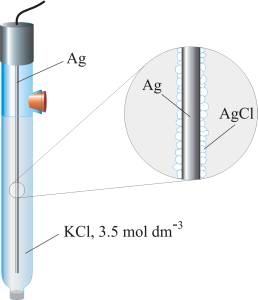
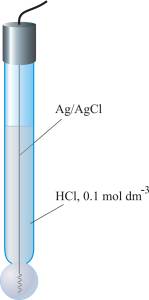
Srebro/srebrov klorid elektroda jedna je od najčešće korištenih referentnih elektroda zbog svoje jednostavnosti, neotrovnosti, niske cijene i stabilnosti. Sastoji se od srebrne žice, prevučene tankim slojem srebrova klorida, uronjene u otopinu kalijevog klorida poznate koncentracije i zasićenog srebrovim kloridom.
Srebro/srebrov klorid elektroda
Ag|AgCl(zas.), KCl(zas)
Elektrodna reakcija u polučlanku je:
AgCl(s) + e- ![]() Ag(s) +Cl-
Ag(s) +Cl-
a potencijal se može prikazati
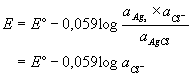
Potencijal ove elektrode iznosi 0.199 V pri temperaturi od 25 °C
Tablica: Ovisnost potencijala referentnih elektroda o temperaturi i koncentraciji KCl
| Potencijal prema SHE / V | |||||
| kalomel elektroda | Ag/AgCl elektroda | ||||
| t / °C | 0.1 mol dm-3 | 3.5 mol dm-3 | zasić. otopina | 3.5 mol dm-3 | zasić. otopina |
|---|---|---|---|---|---|
| 15 | 0.3362 | 0.254 | 0.2511 | 0.212 | 0.209 |
| 20 | 0.3359 | 0.252 | 0.2479 | 0.208 | 0.204 |
| 25 | 0.3356 | 0.250 | 0.2444 | 0.205 | 0.199 |
| 30 | 0.3351 | 0.248 | 0.2411 | 0.201 | 0.194 |
| 35 | 0.3344 | 0.246 | 0.2376 | 0.197 | 0.189 |
Kontaktni potencijal
Kontaktni potencijal nastaje na granici dvaju elektrolita različita sastava kada ioni nastoje prijeći iz otopine s većom koncentracijom u otopinu s nižom koncentracijom dotičnog iona. Manji kationi su pokretljiviji i brže difundiraju, pa se naboji odvajaju. Ravnotežni uvjeti se postižu brzo.
Kontaktni potencijal može se smanjiti stavljanjem pogodnog elektrolita u elektrolitni most koji služi kao veza između otopina. Koncentracija elektrolita u mostu mora biti velika radi što bolje vodljivosti i mora imati ione približno jednake pokretljivosti kako bi difuzni potencijal bio što manji. Zasićena otopina kalijeva klorida odgovara tim zahtjevima i njen kontaktni potencijal iznosi nekoliko milivolta.
Indikatorske elektrode
Indikatorske elektrode koje koristimo u potenciometriji razvrstavamo na temelju razlike u načinu nastajanja razlike potencijala na dodirnoj površini elektroda-otopina. Ova razlika potencijala posljedica je elektrokemijske reakcije na površini elektrode. Pritom nastaje razdvajanje naboja na dodirnoj površini, a time i razlika potencijala između elektrode i otopine koja je s njom u kontaktu.
Dvije su temeljne vrste indikatorskih elektroda: kovinske elektrode i selektivne (membranske) elektrode. Kod kovinskih elektroda razlika potencijala na dodirnoj granici elektroda-otopina posljedica je redoks-reakcije na elektrodi. Kod membranskih elektroda potencijal elektrode proizlazi iz promjene slobodne entalpije reakcije prijelaza iona, ionskom izmjenom, adsorpcijom, ekstrakcijom ili drugim načinom, kroz međusloj membrana-ispitivana otopina.
1. Kovinske indikatorske elektrode
Kovinske indikatorske elektrode se uglavnom razvrstavaju kao: elektrode I. reda, elektrode II. reda i inertne redoks elektrode
a) Elektrode I. reda
Elektrode I. reda su čiste kovine koje su u neposrednoj ravnoteži sa svojim kationima. Primjerice, ravnoteža između kovine M i njezina kationa Mn+ je
Mn+ + ne- ![]() M(s)
M(s)
za koju se potencijal računa prema izrazu
![]()
umjesto ![]() u razrijeđenim otopinama može se uzeti koncentracija [Mn+], pa se elektrodni potencijal može pisati
u razrijeđenim otopinama može se uzeti koncentracija [Mn+], pa se elektrodni potencijal može pisati
![]()
Iz jednadžbe možemo zaključiti da povećanjem koncentracije metalnih iona u otopini, potencijal elektrode postaje pozitivniji, a smanjenjem koncentracije negativniji. Kod nekih kovina često nagib odstupa od idealnog što se može pripisati deformacijama u kristalnoj strukturi ili prisutnosti tankog sloja oksida na površini.
b) Elektrode II. reda
Kovinske elektrode se ne upotrebljavaju samo kao indikatorske elektrode za svoje vlastite katione, već i za određivanje aniona koji s kationom kovine stvaraju teško topljive taloge, odnosno stabilne komplekse. Pa tako primjerice srebrena elektroda uronjena u zasićenu otopinu teško topljivog srebrovog klorida pokazuje reproducibilnu promjenu potencijala u ovisnosti o koncentraciji kloridnog iona u otopini.
Elektrodna reakcija u tom slučaju je
AgCl(s) + e- ![]() Ag(s) + Cl-
Ag(s) + Cl-
pri čemu je E °AgCl = 0.222 V. Aktivitet Ag+ jednak je
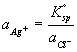
Prema Nernstovoj jednadžbi potencijal elektrode može se prikazati:
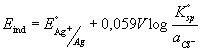
odnosno
![]()
dakle u otopini zasićenoj srebrovim kloridom srebrna elektroda može poslužiti kao indikatorska elektroda drugog reda za kloridne ione.
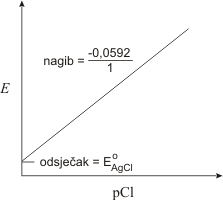
Živa primjerice služi kao indikatorska elektroda drugog reda za anion EDTA, (Y4-).
Kada se mala količina HgY2- doda otopini koja sadrži Y4-, polureakcija se može prikazati:
HgY2- + 2e- ![]() Hg(l) + Y4-
Hg(l) + Y4-
pri čemu je E °(HgY2-) = 0.21 V. Potencijal elektrode može se izraziti:
![]()
Konstanta stabilnosti HgY2- kompleksa je velika (6.3×1021) pa koncentracija kompleksa ostaje konstantna u širokom području koncentracija Y4- te se Nernstova jednadžba može napisati
![]()
gdje je
![]()
dakle živina elektroda se može koristiti kao elektroda drugog reda za praćenje titracije s EDTA.
c) Elektrode III. reda
Elektrode trećeg reda jesu metalne elektrode kojima je elektrodni potencijal funkcija koncentracije nekog drugog kationa, ali ne kationa metala od kojeg je elektroda. Potencijal ovih elektroda ovisi o koncentraciji njihovog kationa u otopini, ali njegova je koncentracija kontrolirana koncentracijom zajedničkog aniona. Koncentracija zajedničkog aniona opet je u ovisnosti o koncentraciji drugog kationa. Ove su elektrode vrlo trome i nestabilne što je posljedica serije ravnoteža koje se moraju uspostavit prije nego što se dobije stabilni potencijal.
Živina elektroda može poslužiti i kao elektroda trećeg reda za mjerenje aktiviteta (koncentracije) kationa koji s Y4- anionom tvore stabilne komplekse, ali manje stabilnosti od HgY2- kompleksa.
d) Inertne metalne elektrode za redoks sustave
Inertne kovine (zlato, platina ili paladij) i ugljik pokazuju odziv na potencijal redoks sustava s kojim su u dodiru. Primjerice, potencijal platinske elektrode uronjene u otopinu koja sadrži cerij(III) i cerij(IV) je:
![]()
Dakle redoks elektrodama nazivamo one kovinske elektrode u kojima metal elektrode sam ne sudjeluje u redoks reakciji, nego služi samo kao nosač elektrona drugog redoks para. Njihov standardni elektrodni potencijal je jako pozitivan, uronjene u otopinu poprimaju potencijal koji ovisi samo o svojstvima redoks sustava u otopini.
2. Membranske elektrode
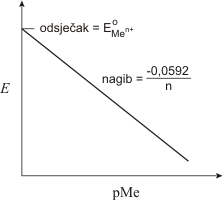
Selektivne membranske elektrode imaju vrlo široku primjenu u potenciometriji. Dizajnirane su tako da njihov potencijal ovisi o aktivitetu samo jedne ionske vrste prisutne u potenciometrijskoj ćeliji.
Pretpostavimo li graničnu površinu između dviju elektrolitni faza kroz koju može prolaziti jedna ionska vrsta tada se ovisno o aktivitetu tih aktivnih iona s jedne odnosno druge strane na graničnoj površini pojavljuje razlika potencijala. Pretpostavimo li da je selektivno ponašanje granične površine ostvareno s pomoću idealne membrane, razlika se potencijala na membrani (Em) pri kojoj se uspostavlja dinamička ravnoteža na graničnoj površini iskazuje relacijom:
![]()
gdje je a i aktivitet iona na jednoj strani a a ir aktivitet iona na drugoj strani.
Pretpostavimo li da je a ir konstantan, E m pišemo
![]()
Dakle prikazujemo ga istom relacijom kao i za redoks sustav iako je način uspostavljanja potencijala različit (na membrani izmjena iona, na kovini redoks reakcija).
Obzirom na sastav membrane membranske elektrode mogu se podijeliti na:
- elektrode s kristalnom membranom mogu imati homogene i heterogene membrane.
- elektrode s nekristalnom membranom su staklene elektrode, elektrode sa mobilnim prenosiocem.
a) Elektrode s kristalnom membranom
Membrana ove elektrode sadrži teško topljivu sol metala kao aktivnu komponentu. Selektivnost ovih membrana je u ovisnosti o konstanti produkta topljivosti teško topljive soli. Potencijal kristalnih membranskih elektroda posljedica je stanja ravnoteže reakcije zamjene iona u otopini i u čvrstoj fazi membrane. Ove elektrode su selektivne na ione sadržane u membrani.
Homogene membrane
Ove membrane sadrže kristalnu supstancu jednog spoja (Ag2S), homogene smjese spojeva (AgI/Ag2S) ili mogu biti monokristalne pločice (LaF3). Često se izrađuju membrane od smjese dviju (rijetko više) kristalnih tvari od kojih je, redovito, samo jedna elektrokemijski aktivna tvar membrane.
Površina elektrode je selektivna i na druge molekulske vrste koji s ionima membrane tvore teško topljive soli ili stabilne topljive komplekse. Tako je membrana izgrađena od Ag2S selektivna za ione Ag+, Cl-, I-, Hg22+ i druge ione koji tvore teško topljive sulfide.
U vodljivim membranama (onima s Ag solima) električni kontakt se može ostvariti izravno preko metalnog vodiča s unutarnjom stranom membrane.
Heterogene membrane
Kod ovih elektroda aktivna tvar je dispergirana u čvrstom, elektrokemijski inaktivnom nosivom materijalu. Kao nosivi materijal najčešće se koristi silikonska guma ili polimerni materijali na bazi poli(vinil-klorida), polietilena i poli(dimetil-silokana).
Heterogene membrane pripravljaju se prešanjem aktivnog materijala pomiješanog sa silikonskom gumom (ili drugim nosivim materijalom). Nakon stvrdnjavanja membrane se lijepe na otvor staklenog ili plastičnog nosača. Električni kontakt se ostvaruje preko unutrašnje elektrolitne otopine i unutrašnje referentne elektrode.
Ove elektrode se moraju prije upotrebe kondicionirati u otopini iona za koje su selektivne.
b) Elektrode s nekristalnom membranom
Ove elektrode sadrže ionske ili nenabijene specije kao aktivne komponente membrana. Inaktivni nosač membrane može biti porozan (npr. mikroporozni filtar) ili neporozan (npr. staklo, PVC).
Staklena elektroda
Staklena elektroda je jedna od prvih membranskih elektroda. Sastoji se od Ag/AgCl elektrode u otopini kloridne kiseline stalnog pH koja se nalazi unutar posudice tankih staklenih stijenki. Pri određivanju pH staklena elektroda se spaja s nekom referentnom elektrodom rad i mjerenja elektromotorne sile članka. Shematski prikaz ovog članka je slijedeći:
ZKE | [H3O+]=a1 | staklena membrana | [H3O+]=a2, [Cl-]=1.0 M, AgCl(zas) | Ag
Membrane su od stakla specijalnog kemijskog sastava i pouzdane su do pH 12, a one od litijevog stakla i iznad pH 12. Na suha stakla pH ne utječe pa se staklena elektroda prije mjerenja mora močiti u vodi. Staklene elektrode imaju veliki otpor pa je s njima moguće raditi samo pomoću vrlo osjetljivih instrumenata - pH-metara. Vodljivost staklene elektrode posljedica je kretanja Na+ i H+ iona.
Veličina E b (graničnog potencijala) ovisi o odnosu koncentracija vodikovih iona u otopinama.
Također postoji i asimetrični potencijal (osim E Ag/AgCl i E b) koji se mijenja polako s vremenom, a čiji izvor nije potpuno objašnjen.
E b = L' - 0.0592 pH
Kada se s obje strane membrane postave identične otopine i referentne elektrode, granični potencijal bi trebao biti jednak nuli. Međutim, često se javlja mali asimetrični potencijal koji se s vremenom mijenja. Nastajanje asimetričnog potencijala nije u potpunosti razjašnjeno ali je vjerojatno posljedica razlike u napetosti površine membrane koja nastaje pri proizvodnji, tijekom uporabe elektrode i sl. Da bi se izbjegle pogreške vrši se baždarenje staklene elektrodae prije mjerenja.
Potencijal staklene elektrode se dakle može iskazati
Eind = Eb + EAg/AgCl + Easi
odnosno
Eind = L + 0.0592 loga1 = L - 0.0592 pH
Staklena elektroda se obično izrađuje kao kombinirana elektrona - referentna i indikatorska elektroda nalaze se u istom tijelu.
Elektrode s mobilnim prenosiocem
Ove elektrode se još nazivaju i elektrode s tekućom membranom, a možemo ih svrstati u tri skupine:
- membrane koje sadrže pozitivno nabijeni mobilni prenosilac (npr. kvaternu amonijevu sol) kao aktivnu tvar membrane, otopljenu u prikladnom otapalu, osjetljive su na promjenu aktiviteta aniona.
- membrane koje sadrže negativno nabijeni mobilni prenosilac (npr. (RO)2PO- ili tetra-p-klorfenilborat) otopljen u prikladnom organskom otapalu kao aktivnu komponentu membrane, osjetljive su na promjenu aktiviteta kationa.
- membrane koje sadrže nenabijeni mobilni prenosilac otopljen u prikladnom otapalu kao aktivnu komponentu membrane (npr. antibiotik valinomicin u difenil-eteru koji gradi kompleks s K+ ili visoko selektivni ligand za Ca2+ otopljen u nitrofenil-oktil eteru). Ovakve membrane osjetljive su na promjenu aktiviteta kationa.
c) Specijalne ion selektivne elektrode (ISE)
Ove elektrode obično sadrže dvije membrane odvojene tankim slojem elektrolitne otopine.
Elektrode za plinove
Ove elektrode sadrže dvije membrane. Između hidrofobne, za plin propusne membrane i membrane selektivne za ione (najčešće staklena membrana pH elektrode) nalazi se tanki sloj elektrolitne otopine, u kojoj interakcijom s određenim plinom nastaju ioni koji utječu na potencijal elektrode. Potencijal elektrode je proporcionalan parcijalnom tlaku mjerenog plina u uzorku.
Enzimske elektrode (bio senzori)
Princip rada ovih elektroda temeljen je na specifičnom katalitičkom djelovanju enzima za selektivno određivanje koncentracije određene molekulske vrste.
Prostor između osjetljive površine selektivne elektrode i dijafragme ispunjen je materijalom u kojem je imobiliziran enzim. Katalitičkim djelovanjem enzima na određenu molekulsku vrstu, koja difundira u taj prostor iz ispitivanog uzorka, nastaje produkt na koji je indikatorska elektroda selektivno osjetljiva.
Prva takva elektroda je bila elektroda za mjerenje koncentracije uree (mokraćevine). Temelji se na reakciji uree s vodom pod utjecajem enzima ureaze:
CO(NH2)2 + 2H2O ![]() 2NH4+ + CO32-
2NH4+ + CO32-
Citiranje ove stranice:
Generalić, Eni. "Potenciometrijski senzori." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/enig/potenciometrijski_senzori.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni