POVIJEST PERIODNOG SUSTAVA
KEMIJSKIH ELEMENATA
Periodni sustav kemijskih elemenata poznat je svakome tko je ikada ušao u znanstveni laboratorij ili učionicu. On nema suparnika svojoj sposobnosti sistematiziranja i racionaliziranja poznatih kemijskih činjenica, predviđanju novih elemenata ili sugeriranju plodnih područja za dalje učenje. Ovaj domišljat i funkcionalan raspored kemijskih elemenata razvilo je nekolikih europskih znanstvenika tijekom 19. stoljeća. Ovdje je dana kratka povijest slaganja tablice periodnog sustava kemijskih elemenata.

Stari grčki filozofi Tales (624.-546.), Anaksimandar (610.-546.) i Heraklit (540.-480.) tvrdili su da je sva materija sastavljena od jednog temeljnog principa - ili elementa. Tales je vjerovao da je ovaj element voda, njegov učenik Anaksimandar zrak a Heraklit vatra. Empedoklo (490.-430.) je vjerovao da su sve tvari sastavljene od četiri elementa: zraka, zemlje, vatre i vode te da miješanjem tih tvari u raznim omjerima nastaje sve u prirodi. Stotinu godina kasnije Aristotel (384.-322.) prihvaća njegovu ideju o četiri elementa i dodaje materiji četiri osnovna svojstva: suho, toplo, vlažno i hladno. To je izgledalo razborito jer se, primjerice, moglo vidjeti kako se zapaljeno drvo raspada na tri elementa: vatru, zrak i zemlju. Od grčke ideje elementa zadržalo se jedino to da elementi imaju karakteristična svojstva.
Trebalo je proći skoro 2000 godina da netko ozbiljnije napadne Aristotelovu teoriju o četiri elementa i nešto suvremenija alkemičarska tri principa (živu, sumpor i sol). To je učinio 1661. "otac moderne kemije", englesko-irski kemičar i prirodoslovac, Robert Boyle (1627.-1691.) u svojoj knjizi "The Sceptical Chymist". Ne ulazeći u prirodu i broj elemenata, Boyle je definirao elemente kao jednostavne tvari, cigle od kojih su napravljene složenije tvari. Složena tijela su napravljena od elemenata i mogu biti rastavljena na te elemente kemijskom analizom.
Prvu tablicu kemijski jednostavnih tvari dao je 1789. francuski kemičar Antoine-Laurent Lavoisier (1743.-1794.) u knjizi "Traité Élémentaire de Chimie". U tom klasičnom djelu Lavoisier se pobrinuo za jezgrovita objašnjenja kako svojeg rada tako i onog njegovih prethodnika. Razjasnio je razliku između elemenata i spojeva i pomagao u smišljanju modernog sustava kemijske terminologije. Njegova tablica elemenata, jednostavnih tvari koje se ne mogu dalje rastaviti i iz kojih je sva druga materija napravljena, sadržavala je 33 elementa podijeljena u četiri skupine: plinove, nemetale, metale i zemlje (Tablica 1.). Ironično je, obzirom na njegov veliki doprinos obaranju flogistonske teorije, da je među elemente svrstao toplinu i svjetlo. Lavoisierovo je ime nerazdvojivo povezano s postavljanjem temelja na kojima leži moderna znanost: smatra se da je za kemiju uradio ono što je Isaac Newton (1642.-1727.) uradio za fiziku.
| Substances simples qui appartiennent aux trois règnes et qu'on peut regarder comme les éléments des corps | Substances simples non-métalliques oxydables et acidifiables | Substances simples métalliques oxydables et acidifiables | Substances simples salifiables terreuses | |
|---|---|---|---|---|
|
Lumière Calorique Oxygène Azote Hydrogène |
Soufre Phosphore Carbone Radical muriatique Radical fluorique Radical boracique |
Antimoine Argent Arsenic Bismuth Cobalt Cuivre Étain Fer Manganèse |
Mercure Molybdène Nickel Or Platine Plomb Tungstène Zinc |
Chaux (CaO) Magnésie (MgO) Barite (BaO) Alumine (KAl(SO4)2·12H2O) Silice (SiO2) |
Engleski kemičar John Dalton (1766.-1844.) predložio je 1803. svoje principe atomske teorije, sugerirajući da su svi elementi sastavljeni od sitnih, neuništivih čestica, zvanih atomi, koji su svi jednaki i imaju istu masu. Atomi nekog elementa mogu pri kemijskoj reakciji ući u molekule kemijskog spoja ili iz njih izaći, ali njihova ukupna masa u sustavu ostaje nepromijenjena. Dalton je pretpostavio da je vodik najlakši element pa je uveo pojam relativne atomske mase (Ar) kao omjer mase atoma elementa i mase atoma vodika (Tablica 2.).

| Simple Elements | |||||
|---|---|---|---|---|---|
| Fig. 1 | Hydrogen, its rel. weight | 1 | Fig. 11 | Strontites (SrO) | 46 |
| Fig. 2 | Azote | 5 | Fig. 12 | Barytes (BaO) | 68 |
| Fig. 3 | Carbone or charcoal | 5 | Fig. 13 | Iron | 38 |
| Fig. 4 | Oxygen | 7 | Fig. 14 | Zinc | 56 |
| Fig. 5 | Phosphorus | 9 | Fig. 15 | Copper | 56 |
| Fig. 6 | Sulphur | 13 | Fig. 16 | Lead | 95 |
| Fig. 7 | Magnesia (MgO) | 20 | Fig. 17 | Silver | 100 |
| Fig. 8 | Lime (CaO) | 23 | Fig. 18 | Platina | 100 |
| Fig. 9 | Soda (Na2CO3) | 28 | Fig. 19 | Gold | 140 |
| Fig. 10 | Potash (K2O) | 42 | Fig. 20 | Mercury | 167 |
| Binary, Ternary and Quaternary Compounds | |||||
| Fig. 21 | An atom of water, composed of 1 of oxygen and 1 of hydrogen | 8 | |||
| Fig. 22 | An atom of carbonic acid, 1 carbone + 2 oxygen | 19 | |||
| Fig. 23 | An atom of sulphuric acid, 1 sulphur + 3 oxygen | 34 | |||
Današnji sustav kemijskih simbola, temeljen na početnom slovu (i eventualno još jednom) latinskog imena elemenata uveo je 1813. švedski kemičar Jöns Jacob Berzelius (1779.-1848.). On je također 1818., nakon desetogodišnjeg ispitivanja preko 2000 spojeva, objavio atomske mase elemenata koje su, za ono vrijeme, bile zapanjujuće točne. Berzelius je smatrao da je kisik mnogo pogodnija jedinica od vodika, pa je relativne atomske mase elemenata računao tako da je masi kisika pridružio vrijednost 100.
| Namen. | Zeichen. | Gewicht. | Namen. | Zeichen. | Gewicht. |
| Oxygenium | O. | 100. | Palladium | Pl. | 1418. |
| Sulphuricum | S. | 201. | Hydrargyrum | Hg. | 2531.6 |
| Phosphoricum | P. | 167.512 | Argentum | Ag. | 2688.17 |
| Muriaticum | M. | 159.56 | Cuprum | Cu. | 806.45 |
| Fluoricum | F. | 60. | Niccolum | Ni. | 733.8 |
| Boracicum | B. | 73.27 | Cobaltum | Co. | 732.61 |
| Carbonicum | C. | 74.91 | Bismuthum | Bi. | 1774. |
| Nitricum | N. | 79.54 | Plumbum | Pb. | 2597.4 |
| Hydrogenium | H. | 6.636 | Stannum | Sn. | 1470.59 |
| Arsenicum | As. | 859.9 | Ferrum | Fe. | 693.64 |
| Molybdaenum | Mo. | 601.56 | Zincum | Zn. | 806.45 |
| Chromium | Ch. | 708.05 | Manganium | Mn. | 711.57 |
| Woframium | W. | 2424.24 | Uranium | U. | 3141.4 |
| Tellurium | Te. | 806.48 | Cerium | Ce. | 1148.8 |
| Stibium | Sb. | 1613. | Yttrium | Y. | 881.66 |
| Tantalum | Ta. | - | Beryllium | Be. | 683.3 |
| Titanium | Ti. | 1801? | Aluminium | Al. | 343. |
| Silicium | Si. | 304.35 | Magnesium | Ms. | 315.46 |
| Zirconium | Zr. | - | Calcium | Ca. | 510.2 |
| Osmium | Os. | - | Strontium | Sr. | 1418.14 |
| Iridium | I. | - | Barytium | Ba. | 1709.1 |
| Rhodium | R. | 1490.3 | Natrium | Na. | 579.32 |
| Platinum | Pt. | 1206.7 | Kalium | K. | 978.0 |
| Aurum | Au. | 2483.8 |
Nakon Lavoisiera sustavni pristup i nove eksperimentalne tehnike uskoro su dovele do otkrića mnoštva novih elemenata. Bilo je potrebno nepunih pedeset godine nakon objave njegove knjige da se broj poznatih elemenata udvostruči. Dvije su tehnike u tome imale značajnu ulogu: elektroliza i velika redukcijska moć alkalijskih metala bili su sjajan alat za izoliranje, a atomska spektroskopija za identifikaciju novih elemenata.
Britanski je znanstvenik Sir Humphry Davy (1778.-1829.) u listopadu 1807., koristeći 250 ploča, napravio najmoćniju bateriju dotada što mu je omogućilo da električnu struju provodi kroz taline umjesto kroz vodene otopine. Elektrolizom taline potaše (K2CO3), smjese za koju se dugo sumnjalo da sadrži novi element, Davy je uspio dobiti sitne kuglice metalnog kalija. Istog tjedna, Davy je, iz kaustične sode (NaOH), dobio i drugi alkalijski metal, natrij. Kada bi se kuglice tih metala ubacile u vodu, zapalile bi se i jurile po površini uz piskav zvuk. Otkriće tih vrlo reaktivnih metala prouzročilo je veliko uzbuđenje, a spektakularne 'demonstracije' ovih novopronađenih elemenata često su uzrokovale da se nekoliko dama u publici onesvijesti.
Njemački fizičar Gustav Robert Kirchhoff (1824.-1887.), proučavajući obojene pare iznad tvari zagrijane do bijelog žara, otkrio je da svaki element daje jedinstven i karakterističan uzorak obojenih linija. Svaki element daje isti set identifikacijskih crta, čak i onda kada je kemijski spojen s drugim elementima. Zajedno s njemačkim kemičarom Robertom Wilhelmom Bunsenom (1811.-1899.) razvio je 1859. spektroskop koji se pokazao kao vrhunski alat za identifikaciju novih elemenata. Upotrebom ovog novog istraživačkog alata otkrili su dva nova elementa, cezij (1860.) i rubidij (1861.). Kirchhoff i Bunsen također su ustanovili da plinovi apsorbiraju zračenje iste valne duljine koje i emitiraju. Proučavajući tamne linije u Sunčevom spektru, otkrili su nekoliko tamnih linija za koje su sumnjali da potječu od elemenata još nepronađenih na Zemlji.
Ovo obilje novih elemenata sa sve širim rasponom svojstava uskoro je počelo izazivati brojna pitanja. Koliko točno elementa postoji? Jesu li već svi otkriveni? Postoji li možda bezbroj elemenata? Neki novi elementi, kao što su alkalijski metali, imali su svojstva toliko različita da se nisu mogli uklopiti u nijednu postojeću skupinu elemenata. Postoji li možda neki temeljni zakon iza svega toga?
Njemački kemičar Johan Döbereiner (1780.-1849.) bio je prvi od niza kemičara koji su prepoznali vezu između atomske mase i kemijskih svojstava. On je primijetio da je, u skupini triju elemenata sličnih kemijskih svojstava, atomska masa drugog člana "trijade" bila skoro točno u sredini atomskih masa druga dva elementa. Primijetio je da je molarna masa stroncijeva oksida vrlo blizu aritmetičkoj sredini molarnih masa kalcijeva oksida i barijeva oksida. Istu pravilnost je primijetio i kod odnosa njihovih specifičnih težina. A ako sumpor, selenij, i telurij pripadaju istoj skupini, kao što se pretpostavljalo, tada bi specifična težina selenija bila aritmetička sredina specifičnih težina sumpora i telurija. Prema tome atomska masa selenija bila bi (32.239 + 129.243)/2 = 80.741 što je bilo vrlo blizu onoj koju je izmjerio Berzelius (78.383). Do sredine stoljeća Döbereinerov 'zakon trijada' proširen je na veće skupine, od četiri i pet elemenata, sličnih svojstava unutar kojih je postojao pravilan porast relativne atomske mase. Döbereiner je svoje ideje izrazio još 1917., ali ih je objavio tek dvanaest godina kasnije kada ih je Berzeliusov rad na određivanju relativnih atomskih masa broma i joda ponovo izbacio na površinu. Primijetio je da nedavno otkriveni element brom ima kemijska svojstva slična onima klora i joda. I ne samo to, njegova atomska masa bila je približno aritmetička sredina atomskih masa ovih dvaju elemenata (35.470 + 126.470)/2 = 80.470 (atomska masa selenija iznosila je 79.263).
| a) Salt-forming elements | b) Acid-forming elements | c) Alkali-forming elements | d) Alkaline-earth-forming elements | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 221.325 | Cl | 201.165 | S | 95.310 | L | 256.019 | Ca | ||||
| 789.145 | I | 806.452 | Te | 489.916 | K | 856.880 | Ba | ||||
|
1010.470
/
2
| Br |
1007.617
/
2
| Se |
585.226
/
2
| Na |
1112.899
/
2
| Sr | ||||
U rujnu 1860. sazvan je Prvi međunarodni kongres kemičara u Karlsruheu u Njemačkoj na koji su došli svi važniji kemičari iz cijele Europe, kao i mnogi koji su ime tek trebali steći. Budućnost kemije ovisila je o rezultatima kongresa. Slučaj o atomskim težinama pokrenuo je vatreni i karizmatični talijanski kemičar Stanislao Cannizzaro (1826.-1910.). On je tvrdio da Avogadrove hipoteze vode direktno do atomske mase plinovitih elemenata, a otud do atomskih masa drugih elemenata. Talijanski fizičar Amedeo Avogadro (1776.-1856.) predložio je 1811. dvije hipoteze: (1) najmanje čestice nekog plina skupine su atoma - molekule; (2) jednaki volumeni različitih plinova, pri istom tlaku i temperaturi, sadržavaju jednak broj molekula. Ako znamo da je volumen kisika 16 puta teži nego isti volumen vodika i ako je atomska masa vodika 1, kisikova mora biti 16. Kako se samo polovica volumena kisika spaja s jednim volumenom vodika dajući vodu, proizlazi da je formula vode H 2O, a ne HO. Cannizzarove ideje brzo su bile prihvaćene i kopije njegovih tablica atomskih težina nestrpljivo su razgrabljene.
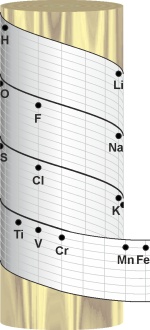
Francuski geolog Alexandre Emile Becuyer De Chancourtois (1820.-1886.) objavio je 1862. članak koji je opisivao njegov 'Vis Tellurique', napravljen s namjerom da provjeri postoji li doista neka pravilnost među elementima. De Chancourtois je papirnatu traku razdijelio na jednake dijelove uzimajući atomsku težinu vodika kao jedinicu. Na tu traku razmjestio je elemente po novim vrijednostima atomskih težina koje je dao Cannizzaro i namotao je u spiralu oko valjaka različitih promjera. Kad je traku namotao na valjak kojem je opseg baze iznosio 16 jedinica atomske mase primijetio je da elementi koji se nalaze okomito jedan iznad drugog imaju slična svojstava. Nažalost, članak je bilo jako teško razumjeti jer je de Chancourtois upotrebljavao geološke nazive, a pogreškom urednika objavljen je bez dijagrama.
Engleski kemičar John Newlands (1837.-1898.) složio je elemente u uzastopni niz po rastućim relativnim atomskim masama, počevši s vodikom i završavajući s torijem. Kada je elemente složio po redu njihovih ekvivalenata (atomske mase prikazane kao višekratnici broja osam), s nekoliko manjih iznimaka, primijetio je da se elementi koji pripadaju istoj skupini obično pojave u istom redu (Tablica 4.). Također je primijetio da se brojevi podudarnih elemenata općenito razlikuju ili za 7 ili za neki višekratnik broja sedam. Tako je u dušikovoj skupini između dušika i fosfora 7 elemenata; između fosfora i arsena 14; između arsena i kositra 14 i između kositra i bizmuta također 14. Zbog sličnosti s intervalima u glazbenoj ljestvici nazvao je taj odnos Zakonom oktava. U ovako tablično raspoređenim elementima natrij se našao pokraj veoma sličnog kalija, magnezij pokraj sličnog kalcija. Kada je Newlands proširio tablicu tako da u nju uključi sve poznate elemente, našao je da su halogeni, klor, brom i jod svi upali u isti horizontalni red. Svojstva nekih elemenata, posebno onih većih atomskih masa, jednostavno se nisu uklapala. Ipak, Newlandsov zakon oktava bio je nedvojbeni napredak pred svim prethodnim idejama. Svoja otkrića saopćio je 1865. u Chemical Society u Londonu, ali okupljeni uglednici ismijali su njegov zakon oktava i sarkastično ga savjetovali da pokuša složiti elemente po abecedi.
| No. | No. | No. | No. | No. | No. | No. | No. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | 1 | F | 8 | Cl | 15 | Co & Ni | 22 | Br | 29 | Pd | 36 | I | 42 | Pt & Ir | 50 |
| Li | 2 | Na | 9 | K | 16 | Cu | 23 | Rb | 30 | Ag | 37 | Cs | 44 | Os | 51 |
| G | 3 | Mg | 10 | Ca | 17 | Zn | 24 | Sr | 31 | Cd | 38 | Ba & V | 45 | Hg | 52 |
| Bo | 4 | Al | 11 | Cr | 19 | Y | 25 | Ce & La | 33 | U | 40 | Ta | 46 | Tl | 53 |
| C | 5 | Si | 12 | Ti | 18 | In | 26 | Zr | 32 | Sn | 39 | W | 47 | Pb | 54 |
| N | 6 | P | 13 | Mn | 20 | As | 27 | Di & Mo | 34 | Sb | 41 | Nb | 48 | Bi | 55 |
| O | 7 | S | 14 | Fe | 21 | Se | 28 | Ro & Ru | 35 | Te | 43 | Au | 49 | Th | 56 |
(Tamo gdje dva elementa imaju isti ekvivalent, oba su označena istim brojem.)
Döbereiner je opazio sličnosti među izoliranim skupinama elemenata. De Chancourtois je prepoznao određeni uzorak u ponavljanju svojstava. Newlands je proširio ovu pravilnost, ali još uvijek njegov zakon oktava nije općenito funkcionirao. Ovo je bilo djelomično zbog suvremenih pogrešaka u računanju raznih atomskih masa, a djelomično i zato što Newlands nije ostavio mjesta za tada još neotkrivene elemente.
Sredinom stoljeća bilo je sve očitije da postoji neka pravilnost u rasporedu elemenata. Cooke, Cremers, Gladstone, Gmelin, Lenssen, Pettenkofer i posebno Dumas već su bili otkrili mnoge činjenice koje su pridonosile tom mišljenju. Činilo se da je dovoljan i letimičan pogled na elemente da objasni zakon po kojem se oni slažu. Elementi su se mogli poredati po njihovim uzlaznim atomskim težinama, ili su se mogli grupirati u skupine sa sličnim svojstvima, ali opći raspored elemenata i dalje je bio neuhvatljiv.

Njemački kemičar Julius Lothar Meyer (1830.-1895.) ustanovio je da su fizičke osobine elementarnih tvari (atomski volumen, talište, vrelište, gustoća itd.) periodične funkcije relativne atomske mase. Meyer je bio pod snažnim utjecajem Cannizzarovih ideja i prvi put je svoje ideje o odnosu fizikalnih svojstava elemenata i njihove atomske mase predstavio 1864. u svom udžbeniku "Die Modernen Theorien der Chemie". U njemu je Meyer dao tablicu s dvadeset osam elemenata poredanih po atomskoj težini u šest obitelji, a kao vezu među članovima obitelji uzeo je valenciju.
Meyer je primijetio da je jedno od svojstava koje se pravilno mijenja s atomskom masom atomski volumen elemenata. Stavljajući relativne atomske mase kao apscisu, a atomske volumene kao ordinatu, dobio je isprekidanu krivulju i to s prekidima osobito oštro izraženim kod relativnih atomskih masa alkalijskih metala (Slika 3.). Na temelju tih svojih otkrića sastavio je periodičku tablicu koja je jako nalikovala današnjoj i u kojoj je vodik imao posebno mjesto. Nažalost, on je svoju tablicu (Tablica 5.) objavio tek 1870.
| I. | II. | III. | IV. | V. | VI. | VII. | VIII. | IX. |
|---|---|---|---|---|---|---|---|---|
| B=11.0 | Al=27.3 | -- | ?In=113.4 | Tl=202.7 | ||||
| -- | -- | -- | ||||||
| C=11.97 | Si =28 | -- | Sn=117.8 | Pb=206.4 | ||||
| Ti=48 | Zr=89.7 | -- | ||||||
| N=14.01 | P=30.9 | As=74.9 | Sb=122.1 | Bi=207.5 | ||||
| V=51.2 | Nb=93.7 | Ta=182.2 | ||||||
| O=15.96 | S=31.98 | Se=78 | Te=128? | -- | ||||
| Cr=52.4 | Mo=95.6 | W=183.5 | ||||||
| - | F=19.1 | Cl=35.38 | Br=79.75 | I=126.5 | -- | |||
| Mn=54.8 | Ru=103.5 | Os=198.6? | ||||||
| Fe=55.9 | Rh=104.1 | Ir=196.7 | ||||||
| Co = Ni = 58.6 | Pd=106.2 | Pt=196.7 | ||||||
| Li=7.01 | Na=22.99 | K=39.04 | Rb=85.2 | Cs=132.7 | -- | |||
| Ag=107.66 | Au=196.2 | |||||||
| ?Be=9.8 | Mg=23.9 | Ca=39.9 | Sr=87.0 | Ba=136.8 | -- | |||
| Zn=64.9 | Cd=111.6 | Hg=199.8 | ||||||
Meyerova tablica sadržavala je samo 54 elementa jer on nije u nju uključio elemente u čije je podatke sumnjao i koji se nisu mogli uklopiti u njegovu tablicu. Tako u njegovoj tablici nedostaju, osim vodika, svi lantanoidi i aktinoidi koji su bili poznati u to vrijeme (Y, Eb, (Tb?), Ce, La, Di, Th, U). Smatrao je da će ovi elementi ili neki još nepoznati popuniti praznine u tablici, kao i da će, možda, zbog budućih otkrića neki od elemenata zamijeniti mjesto.
Za profesora Opće kemije na Sveučilištu u St. Petersburgu postavljen je 1867. Dmitrij Ivanovič Mendeljejev (1834.-1907.). Budući da nije našao udžbenik koji bi zadovoljio njegove potrebe, započeo je pisanje vlastitog: rezultat je bio klasični udžbenik "Principi kemije" koji je nastajao od 1868. do 1870. Tijekom pisanja knjige Mendeljejev je potanko ispitivao odnose među svojstvima elemenata ne bi li napravio sustav koji bi ih klasificirao. Bilo je potrebno pronaći neki temeljni princip po kojem bi elemente mogao poredati jer je struktura cijele knjige ovisila o tome. Dotad su šezdeset i tri različita kemijska elementa bila poznata. Znalo se da svaki od elemenata sadrži drugačije atome i da atomi svakog elementa imaju svoja vlastita jedinstvena svojstva. Međutim, neki elementi posjedovali su slična svojstva što je omogućavalo da ih se klasificira zajedno po skupinama.
Mendeljejev je povezao problem elemenata i svoju omiljenu kartašku igru - pasijans. Upisao je imena elemenata na prazne karte, dodajući uz njih njihove atomske mase i kemijska svojstva. Nadao se da će se elementi složiti slično kao karte: po skupinama sličnih svojstava (kao boje u kartama) i u svakoj skupini poredati u nizu po veličini njihovih atomskih masa (oponašajući numerički niz u kartama). On je u svojoj glavi vidio kako se elementi slažu po njihovim atomskih težinama a njihova svojstva ponavljaju u periodičkim intervalima. Ova tablica i popratne primjedbe, pod naslovom "O međusobnoj povezanosti svojstava elemenata i njihovih atomskih težina ", prvi put su predstavljene Ruskom kemijskom društvu 1. ožujka 1869., a članak je objavljen u prvom svesku novog glasila društva.
| Ti=50 | Zr=90 | ?=180 | |||
| V=51 | Nb=94 | Ta=182 | |||
| Cr=52 | Mo=96 | W=186 | |||
| Mn=55 | Rh=104.4 | Pt=197.4 | |||
| Fe=56 | Ru=104.4 | Ir=198 | |||
| Ni=Co=59 | Pd=106.6 | Os=199 | |||
| H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
| Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
| B=11 | Al=27,4 | ?=68 | Ur=116 | Au=197? | |
| C=12 | Si=28 | ?=70 | Sn=118 | ||
| N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
| O=16 | S=32 | Se=79.4 | Te=128? | ||
| F=19 | Cl=35.5 | Br=80 | J=127 | ||
| Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
| Ca=40 | Sr=87.6 | Ba=137 | Pb=207 | ||
| ?=45 | Ce=92 | ||||
| ?Er=56 | La=94 | ||||
| ?Yt=60 | Di=95 | ||||
| ?In=75.6 | Th=118? |
U pretpostavljenom je sustavu atomska težina elementa jedinstvena i ona služi kao osnova za odlučivanje o mjestu elementa. Usporedba skupina dotad poznatih elemenata po težinama njihovih atoma vodi do zaključka da raspodjela elemenata po njihovim atomskim težinama ne narušava prirodne sličnosti koje postoje između elemenata već, naprotiv, izravno ukazuje na njih.
Sam Mendeljejev priznavao je da postoje neke nedosljednosti u ovoj shemi. U slučajevima kad atomske mase ne slijede točno uzlazni redoslijed, Mendeljejev je sumnjao u atomsku težinu elementa, sugerirajući da je ona pogrešno izračunata. Tamo gdje se ni jedan element nije uklapao u shemu, on je jednostavno ostavio prazno mjesto, predviđajući da će te praznine jednom biti popunjene elementima koji još nisu otkriveni. Postojala su i neka mjesta gdje je izgledalo da kemijska svojstva ne slijede uzorak, ili da se elementi trebaju presložiti. Unatoč ovim očiglednim anomalijama Mendeljejev je osjećao da je u pravu. Bio je duboko uvjeren da se ove nepravilnosti mogu objasniti i da u njegovom periodnom zakonu, kako ga je on nazvao, mora postojati odgovor.
Dvije godine kasnije, 1871, Mendeljejev je dao novu tablicu periodnog sustava potanko prikazavši periodni zakon. U svom pristupu pošao je još i dalje izjavom da je moguće predvidjeti svojstva još neotkrivenih elemenata te je za tri nova elementa (eka-aluminij, eka-bor i eka-silicij) sugerirao moguća svojstva, uključujući gustoću, radijus i odnose pri spajanju s kisikom. Znanstveni svijet bio je zbunjen, a mnogi su se izrugivali Mendeljejevljevim predviđanjima. Štoviše, godine koje su slijedile bile su iznenađujuće jalove glede otkrivanja novih elemenata.
R e i h e n |
Gruppe I. – R2O |
Gruppe II. – RO |
Gruppe III. – R2O3 |
Gruppe IV. RH4 RO2 |
Gruppe V. RH3 R2O5 |
Gruppe VI. RH2 RO3 |
Gruppe VII. RH R2O7 |
Gruppe VIII. – RO4 |
|---|---|---|---|---|---|---|---|---|
| 1 | H=1 | |||||||
| 2 | Li=7 | Be=9,4 | B=11 | C=12 | N=14 | O=16 | F=19 | |
| 3 | Na=23 | Mg=24 | Al=27,3 | Si=28 | P=31 | S=32 | Cl=35,5 | |
| 4 | K=39 | Ca=40 | – =44 | Ti=48 | V=51 | Cr=52 | Mn=55 | Fe=56, Co=59,
Ni=59, Cu=63 |
| 5 | (Cu=63) | Zn=65 | – =68 | – =72 | As=75 | Se=78 | Br=80 | |
| 6 | Rb=85 | Sr=87 | ?Yt=88 | Zr=90 | Nb=94 | Mo=96 | – =100 | Ru=104, Rh=104,
Pd=106, Ag=108 |
| 7 | (Ag=108) | Cd=112 | In=113 | Sn=118 | Sb=122 | Te=125 | J=127 | |
| 8 | Cs=133 | Ba=137 | ?Di=138 | ?Ce=140 | – | – | – | – – – – |
| 9 | (–) | – | – | – | – | – | – | |
| 10 | – | – | ?Er=178 | ?La=180 | Ta=182 | W=184 | – | Os=195, Ir=197,
Pt=198, Au=199 |
| 11 | (Au=199) | Hg=200 | Tl=204 | Pb=207 | Bi=208 | – | – | |
| 12 | – | – | – | Th=231 | – | U=240 | – | – – – – |
A onda je, u kasno ljeto 1875., francuski kemičar Paul Lecoq de Boisbaudran otkrio novi element u uzorku cinkova sulfida. Svojstva novootkrivenog elementa, nazvanog galij po latinskom imenu za Francusku, frapantno su nalikovala eka-aluminiju. Da to nije slučaj, pokazalo se već 1879. Nilsonovim otkrićem skandija sa svojstvima koja je Mendeljejev predvidio za eka-bor. Ova otkrića, koja su bila potvrda njegovih predviđanja i dokaz njegovog zakona, dovela su Mendeljejeva u sam vrh znanstvenog svijeta, a Englesko kraljevsko društvo odlikovalo je 1882. Mendeljejeva i Meyera Davyjevom medaljom. Nekoliko godina kasnije, 1886., njemački je kemičar Clemens Winkler, tijekom rutinske analize minerala argirodita, otkrio novi element, germanij, čija su svojstva odgovarala onima koje je Mendeljejev predviđao za eka-silicij.
I Meyer i Mendeljejev nalazili su se među kemičarima koji su prisustvovali Kongresu u Karlsruheu 1860., i bili pod jakim dojmom Cannizzarova izlaganja Avogadrovih hipoteza. Obojici je pisanje udžbenika bio poticaj za razvoj periodičke tablice - načina da se studentima predstavi nešto više od šezdeset poznatih elementa. Koristeći slične redove kao i Mendeljejev, Mayer je u konačnici pronašao gotovo isti uzorak među elementima, i to u isto vrijeme kad i Mendeljejev. Zašto je onda bilo tako teško složiti periodičku tablicu? Problem je bio u tome što su kemičari 19. stoljeća elemente slagali po pogrešnom 'zakonu': svojstva elemenata nisu bila periodička funkcija njihovih atomskih masa, već atomskih brojeva. Tu je do izražaja došla Mendeljejevljeva intuicija i sposobnost uočavanja reda u naizgled nepovezanim podacima. On je u svojoj glavi vidio mjesto svakog elementa u tablici i čak ni činjenice nisu bile dovoljne da zamute tu sliku. Tako je on kasnije primijetio: "Iako postoje sumnje u neka nerazjašnjena mjesta, ja još ni jednom nisam posumnjao u univerzalnost ovoga zakona. "
Godine 1894. britanski znanstvenici Lord Rayleigh (1842.-1919.) i sir William Ramsay (1852.-1916.) izolirali su novi element iz zraka (argon) za koji u periodnom sustavu nije bilo mjesta. Novi je element izgledao kao da se sukobljava s već utemeljenim znanjem o elementima. Tek je izoliranje helija 1895. iz uranijeva minerala clevita bacilo novo svjetlo na ovaj problem. Ramsay je 1897. predložio postojanje skupine inertnih plinova i unutar nje predvidio prazna mjesta za još neotkrivene elemente. Do kraja stoljeća Ramsay i njegovi suradnici izolirali su ostale plemenite plinove - neon, kripton i ksenon. Zanimljivo je da su sva trojica, i Meyer i Mendeljejev i Ramsay, studirali u Heidelbergu kod Roberta Bunsena premda u različito vrijeme.
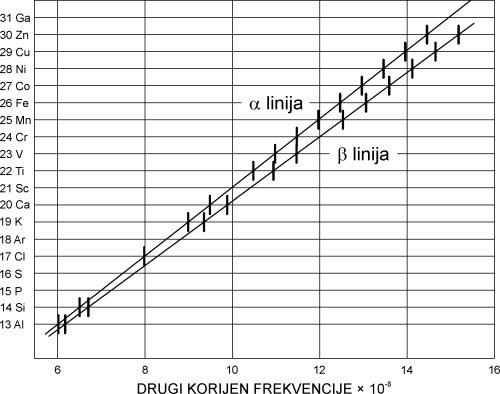
Skoro pedeset godina nakon Mendeljejeva, 1913., britanski kemičar Henrik Moseley (1887.-1915.) objavio je rezultate mjerenja valnih duljina rendgenskih zraka dobivenih s antikatodama raznih elemenata. On je primijetio da se valne duljine rendgenskih zraka pravilno mijenjaju u redu elemenata s rastućim atomskim masama. Moseley je svakom elementu u nizu dodijelio broj koji je nazvao rednim (atomskim) brojem elementa (Z), i umjesto po atomskoj težini preuredio tablicu periodnog sustava po rastućim atomskim brojevima.
Nakon otkrića plutonija (1940.) američki fizičar Glenn Theodore Seaborg (1912.-1999.) predstavio je 1944. svoj "aktinoidni koncept" koji je postao temelj za mnoga važna otkrića u istraživanjima teških elementa. Ovaj je koncept predviđao da će četrnaest aktinoida, koji su uključivali prvih jedanaest transuranijevih elemenata, formirati skupinu prijelaznih elemenata poput lantanoida. Proricanja kemijskih svojstava i rasporeda ovih teških elemenata pomoglo je Seaborgu i njegovim suradnicima da dodaju ukupno deset novih elementa u periodni sustav (plutonij, americij, kurij, berkelij, kalifornij, einsteinij, fermij, mendelevij, nobelij i seaborgij).
Periodički zakon razotkrio je važne analogije među elementima, te je potakao zanimanje za anorgansku kemiju koje se održalo sve do danas tvorbom umjetnih, kratkoživućih elemenata u modernim akceleratorima. Od prvog Mendeljejevljeva referata predloženo je više od 700 različitih oblika periodnog sustava elemenata razvrstanih u 146 različitih tipova ili podtipova.
Bibliografija:
- I. Filipović, S. Lipanović: Opća i anorganska kemija, Školska knjiga, Zagreb, 1982.
- J. Emsley, The Elements, Oxford University Press, New York, 2000.
- P. Strathern, Mandeleyev's Dream: The Quest for the Elements, Thomas Dune Books, New York, 2000.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, Oxford, 2001.
- "Encyclopedia Britannica 2004 Ultimate Reference Suite DVD". Encyclopedia Britannica Inc. 2004.
- Rod Beavon. "Periodicity." 21 Dec. 2002. <http://www.rod.beavon.clara.net/periodic.htm>.
- "Selected Classic Papers from the History of Chemistry", 5 Dec. 2002. <http://webserver.lemoyne.edu/giunta/papers.html>.
- "From Alchemy to Chemistry: Five Hundred Years of Rare and Interesting Books". University of Illinois. 11 Apr. 2010. <http://www.scs.uiuc.edu/~mainzv/exhibit/>.
- Boyle, Robert. "The sceptical chymist." J.M. Dent & Sons, ltd. London, 1911. Retrieved 16 July 2017 via <HathiTrust Digital Library>.
- Lavoisier, Antoine-Laurent de. "Traité Élémentaire de Chimie." Cuchet, Paris, 1793. Retrieved 19 July 2017 via <Bibliothèque nationale de France>.
- Berzelius, Jöns Jacob. "Neues System der Mineralogie." Schrag. Nürnberg, 1816. Retrieved 23 July 2017 via <Bayerische Staatsbibliothek>.
- Döbereiner, Johan. Annalen der Physik und Chemie 2 Folge: Bd. 15-16. p. 301-307. Leipzig. 1829. Retrieved 3 Aug. 2017 via <HathiTrust Digital Library>.
- Cannizzaro, Stanislao. "Sketch of a course of chemical philosophy." Alembic Club. Edinburgh, 1858. Retrieved 28 July 2017 via <Internet Archive>.
- Chancourtois, A. E. Becuyer de. "A first foreshadowing of the periodic law." Nature. p. 186-188. London, 1889. Retrieved 28 July 2017 via <Dolnośląska Digital Library>.
- Meyer, Julius Lothar. "Die Natur der chemischen Elemente als Function ihrer Atomgewichte." Annalen der Chemie. Supplementband 7. 354. 1870. Retrieved 17 July 2017 via <Selected Classic Papers from Le Moyne College>.
Citiranje ove stranice:
Generalić, Eni. "Povijest periodnog sustava kemijskih elemenata." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/povijest_periodnog_sustava_elemenata.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
