VOLUMETRIJSKE METODE ANALIZE
Kemijsko-tehnološki fakultet u Splitu
Eni Generalić
Kemijsko-tehnološki fakultet u Splitu
Volumetrijske metode analize ili skraćeno volumetrija analitičke su metode zasnovane na mjerenju volumena dodanog reagensa standardne otopine. Određivanja se izvode na način da se otopini tvari koja se određuje dodaje otopina reagensa poznate koncentracije sve dok određivana tvar potpuno ne izreagira s reagensom.
Opisana operacija se naziva titracijom, reagens kojim se vrši titracija naziva se titrans, a titrirana tvar analitom. Zbog toga se volumetrijske metode analize nazivaju i titrimetrijskim. Ovisno o vrsti kemijske reakcije volumetrijske metode temelje se na:
- kiselo-baznim reakcijama
- acidimetrija
- alkalimetrija
- redoks-reakcijama
- oksidometrija - permanganometrija
- reduktometrija - jodometrija
- reakcijama taloženja
- argentometrija
- reakcijama stvaranja kompleksa
- kompleksometrija
Da bi se mogla pimjenjeniti za volumetrijsku analizu, kemijska reakcija mora:
- imati točno definiran stehiometrijski odnos,
- biti kvantitativna,
- biti vrlo brza,
- postojati mogućnost određivanja završetka reakcije.
Kod titracije se standard otopina reagensa, postupno dodaje iz birete otopini titrirane tvari, sve dotle dok njena količina ne bude stehiometrijski ekvivalentna količini tvari koja se određuje.
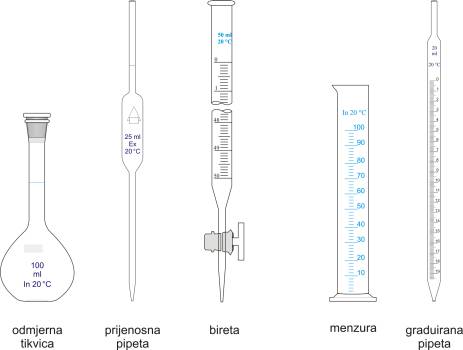
Odmjerno posuđe
Za točna mjerenje volumena u kvantitativnoj analizi upotrebljavaju se odmjerne tikvice, prijenosne pipete i birete, a za mjerenja volumena čija točnost nije toliko važna koriste se menzure i graduirane pipete. Sav stakleni pribor izrađuju se od stabilnog i kemijski otpornog stakla, iako treba pripaziti jer ni ovo staklo nije otporno na jake lužine. Međunarodni je dogovor da se sve odmjerno analitičko posuđe baždari pri 20 °C.
Odmjerne tikvice su baždarene na uljev, a na svakoj tikvici je označen volumen i temperatura pri kojoj je tikvica baždarena. Odmjerne tikvice se ne smiju zagrijavati niti se u njima smiju izvoditi kemijske reakcije. Sve prijenosne pipete baždarene su na izljev. Gornja sužena cijev prijenosne pipete ima na sebi prstenastu oznaku (marku) koja nam označava njen nazivni volumen. Volumetrijsko posuđe je prljavo ako nakon istjecanja tekućine ostanu kapi na stjenkama posuđa.
| Volumen | prijenosne pipete | odmjerne tikvice | |||||||
|---|---|---|---|---|---|---|---|---|---|
| mL | 5 | 10 | 25 | 50 | 100 | 100 | 250 | 500 | 1000 |
| Dopuštena pogreška ± ml |
0.01 | 0.02 | 0.03 | 0.04 | 0.06 | 0.06 | 0.10 | 0.15 | 0.20 |
| Relativna pogreška ± % |
0.20 | 0.20 | 0.12 | 0.08 | 0.06 | 0.06 | 0.04 | 0.03 | 0.02 |
Standard otopine u volumetriji
Otopine reagensa točno poznate koncentracije nazivaju se standard otopinama. Točnost volumetrijske metode direktno ovisi o točnosti koncentracije standard otopine. Točnu koncentraciju standard otopine možemo dobiti na dva načina:
- Preciznim vaganjem potrebne količine čiste tvari i otapanjem u točno poznatom volumenu. Tvari iz kojih se može vaganjem i otapanjem pripraviti otopina točne koncentracije nazivaju se primarnim standardom. Da bi neka tvar bila primarni standard mora:
- imati točno određen kemijski sastav i najviši stupanj čistoće
- biti stabilna na zraku (ne smije reagirati s CO2, vlagom, kisikom, ne smije biti hlapiva ili higroskopna)
- biti stabilna u otopini
- Vaganjem i otapanjem tvari pripremi se otopina približne koncentracije, a točna koncentracija se odredi odgovarajućim primarnim standardom. Ovaj postupak se naziva standardizacijom, a tvari iz kojih se ne može vaganjem i otapanjem pripraviti otopina točne koncentracije nazivaju se sekundarni standardi.
Indikatori u volumetriji
Za provedbu titracije potrebno je, osim otopine uzorka i standard otopine, imati i indikator koji će pokazati točku završetka titracije, tj. koji će dati neku vidljivu promjenu u otopini, u trenutku kad je reakcija završena.
Da bi neka tvar bila upotrebljena kao obojeni indikator mora njena osjetljivost biti visoka, tako da već u vrlo niskim koncentracijama (10-4 - 10-5 mol dm-3) dovoljno jasno boja titriranu otopinu. Ravnoteža između dva indikatorska oblika mora se uspostavljati brzo, skoro trenutno.
Ako se vizualno određivanje završne točke postiže pomoću samog reakcijskog sustava govorimo o samoindikaciji završne točke. Takav slučaj imamo kod titracije sa standard otopinom permanganata.
Indikatori se mogu podijeliti prema vrsti kemijskih reakcija u kojima se primjenjuju za određivanje kraja kemijske reakcije pa imamo kiselo-bazne indikatore, redoks indikatore, metalo indikatore (kod reakcija metalnih iona s EDTA), taložne, kompleksirajuće, adsorpcijske indikatore.
Instrumenti, kao što su spektrofotometri, konduktometri, a naročito pH-metri, sve češće se koriste za određivanje završetka titracije, odnosno ekvivalentne točke reakcije.
Instrumentalno određivanje završne točke ima niz prednosti u odnosu na korištenje indikatora. Vizualno određivanje završne točke opterećeno je subjektivnim faktorima, a ne može se koristiti u mutnim i obojenim otopinama. Potenciometrijske metode određivanja završne točke mogu se primijeniti, ne samo za kiselo-bazne titracije već i kod taložnih, redoks i drugih titracija.
Titracijska krivulja ima karakterističan sigmoidalni oblik. Dio krivulje s maksimalnom promjenom potencijala je ekvivalentna točka titracije. Točku ekvivalencije možemo točnije odrediti iz diferencijalne krivulje ΔE/ΔV gdje maksimum krivulje određuje točku ekvivalencije.
Računanje u volumetriji
Za opću jednadžbu titracije analita (A) sa standard otopinom (B)
Iz volumena (VB) i koncentracije (cB) utrošene standard otopine, uz poznavanje stehiometrije kemijske reakcije (stehiometrijskih koeficijenata a i b), izračuna se količina tražene tvari (nA).
Postupak kako se dolazi do gornje jednadžbe možete pronaći na stranici gdje je opisan stehiometrijski račun.
1. Metode zasnovane na kiselo-baznim reakcijama
Kiselo-baznim titracijama (acidimetrija i alkalimetrija) određuju se kiseline, lužine, soli jakih kiselina i slabih baza i soli jakih baza i slabih kiselina. Kako se reakcija između ekvivalentne količine kiseline i lužine zove neutralizacija, volumetrijske metode zasnovane na ovim reakcijama nazivaju se i metodama neutralizacije.
Ekvivalentna točka titracije će biti pri pH 7 samo kod titracije jakih kiselina s jakim lužinama i obratno, dok će se u svim drugim slučajevima ekvivalentna točka biti pomaknuta u kiselo ili bazno područje, ovisno o hidrolizi nastale soli.
Primarni standardi u volumetrijskim metodama zasnovanim na kiselo-baznim reakcijama su natrijev karbonat (Na2CO3), natrijev tetraboratdekahidrat (Na2B4O7×10H2O) i kalijev hidrogenftalat (HK(C8H4O4)).
Kao standard otopine u acidimetriji najčešće se koristi otopina klorovodiče kiseline (HCl) ili sumporne kiseline (H2SO4), a kao standard otopina u alkalimetriji otopina natrijevog hidroksida (NaOH).
Indikatori u kiselo-baznim titracijama su slabe organske kiseline ili baze koje mogu dati ili primiti protone, mijenjajući pri tome svoju boju. Interval pH u kojem se može uočiti promjena boje kiselo-baznog indikatora naziva se intervalom promjene boje ili intervalom prijelaza indikatora i u prosjeku iznosi oko 2 pH jedinice.
| Indikator | Boja | pH područje promjene boje | |
|---|---|---|---|
| kisela-bazna | 18 °c | 100 °c | |
| metil oranž | crvena - žuta | 3.1 - 4.4 | 2.5 - 3.7 |
| bromfenolno modrilo | žuta - modra | 3.0 - 4.6 | 3.0 - 4.5 |
| metilno crvenilo | crvena - žuta | 4.4 - 6.2 | 4.0 - 6.0 |
| bromkrezol zeleno | žuta - modra | 4.0 - 5.6 | 4.0 - 6.0 |
| fenolftalein | bezbojna - crvenoljubičasta | 8.0 - 10.0 | 8.0 - 9.2 |
| timolftalein | bezbojna - modra | 9.4 - 10.6 | 8.9 - 9.6 |
2. Metode zasnovane na redoks-reakcijama
Volumetrijske metode zasnovane na redoks-reakcijama su brojnije i raznovrsnije nego bilo koja druga grupa volumetrijskih metoda. To je omogućeno činjenicom da se elemenati mogu pojavljivati u više oksidacijskih stanja i da je izbor standardnih otopina veći nego kod drugih metoda. Mogućnost primjene redoks-metoda se znatno proširuje primjenom kompleksirajućih tvari koje, stvaranjem kompleksa s titriranom tvari, mjenjaju elektrodni potencijal.
Redoks-titracije se temelje na reakcijama oksidacije i redukcije. Da bi reakcija između dva redoks-para bila kvantitativna, razlika između njihovih redoks-potencijala u otopini mora biti dovoljno velika.
Karakteristika svakog redoks sustava je njegov redoks potencijal. Za opći redoks sustav
promjena potencijala može se izračunati pomoću Nernstove jednadžbe za elektrodni potencijal:
Tokom titracije do točke ekvivalencije raste potencijal redoks sustava koji se titrira (Aoks.|Ared.). U točki ekvivalencije izjednačuju se potencijali oba sustava a zatim raste potencijal sustava standard otopine (Bred.|Boks.).
Kao oksidativni standardi u redoks titracijama najčešće se koriste:
- kalijev permanganat KMnO4
- otopina cerijevih soli, Ce(IV)
- kalijev bromat KBrO3
- jod (I2)
a kao reduktivni standardi:
- oksalna kiselina, H2C2O4
- natrijev tiosulfat, Na2S2O3
U upotrebi je više načina indiciranja završne točke redoks titracije:
- redoks-indikatori
- škrob
- metilensko plavo
- obojena standardna otopina KMnO4
Redoks indikatori su obično organske tvari koji se ponašaju kao slabi reducensi ili slabi oksidansi i kod kojih je boja oksidiranog i reduciranog oblika različita.
| Indikator | Boja | EoIn / V | |
|---|---|---|---|
| reduciranog oblika | oksidiranog oblika | ||
| feroin | svijetlo plava | crvena | 1.14 |
| difenilamin-sulfonska kiselina | crveno ljubičasta | bezbojna | 0.85 |
| difenilamin | ljubičasta | bezbojna | 0.76 |
2.1. Permanganometrija
Permanganometrija obuhvaća redoks metode pri kojima se kao titracijska otopina upotrebljava otopina kalijevog permanganata (KMnO4). Kalijev permanganat spada u jaka oksidacijska sredstva, a sposobnost oksidacije ovisi o kiselosti sredine:
a) u jako kiseloj sredini
b) u slabo kiseloj ili neutralnoj sredini
U permanganometriji nije potreban indikator za određivanje završne točke titracije, jer prva suvišna kap kalijevog permanganata oboji otopinu slabo ružičasto.
2.2. Jodometrija
Jodometrija (ili indirektna jodimetrija) je reduktometrijska metoda koja se temelji na reakciji titracije otopine joda s otopinom natrijeva tiosulfata prema jednadžbi
Jodometrijom se određuju one oksidativne tvari koje mogu oksidirati jodid u jod kao što su Br2, Cl2, MnO4-, BrO3-, Cr2O72-, OCl-, O3, Fe3+, AsO43-, i drugi. Bit određivanja jest u tome da kiseloj otopini oksidativnog analita dodamo kalijevog jodida u suvišku. Izlučena količina joda, koja je ekvivalentna količini prisutnog oksidativnog analita, odredi se titracijom sa standard otopinom natrijevog tiosulfata:
U jodometriji, za određivanje završne točke titracije, koristi se vodena otopina škroba. Vodena otopina joda obojena je žutom do smeđom bojom koja se teško uočava, međutim kada se u takvu otopinu koja sadrži jod i jodid ione doda škrob, otopina poprimi intenzivno modru boju.
3. Taložne Metode
Taložne volumetrijske metode temelje se na principu da ispitivani analit sa standard otopinom u brzoj reakciji stvara teško topljivu sol točno poznatog stehiometrijskog sastava.
Prva volumetrijska metoda, koju je 1832. izradio Joseph-Louis Gay-Lussac (1778-1850) u povodu natječaja što ga je Pariška kovnica novca raspisala za izradu metode za brzo određivanje srebra u novcu, bila je taložna metoda. Bit te metode bila je u tome da se u dušično-kiseloj otopini otopina srebrovog iona titrira otopinom natrijevog klorida sve dok se bistra otopina iznad taloga ne prestane mutiti od nastalog srebrovog klorida.
Taložnim volumetrijskim metodama najčešće se određuju srebro i halogenidi, a temelje se na reakciji
Srebrov klorid je bijeli, koloidni talog koji snažnim mučkanjem u kiseloj sredini koagulira i brzo se sliježe na dno posude. Talog srebrovog klorida je praktički netopljiv u vodi (0.19 mg u 100 cm3 vode).
Kod taložnih volumetrijskih metoda mogu se primjeniti tri vrste indikatora:
- indikatori koji stvaraju obojeni talog
- indikatori koji stvaraju obojeni kompleks
- adsorpcijski indikatori
4. Metode zasnovane na reakcijama stvaranja kompleksa
Kompleksometrija obuhvaća skup volumetrijskih metoda koje se temelje na svojstvu aminopolikarbonskih kiselina, da s 2-, 3-, i 4-valentnim metalnim ionima stvaraju u vodi lako topljive, ali slabo disocirane komplekse.
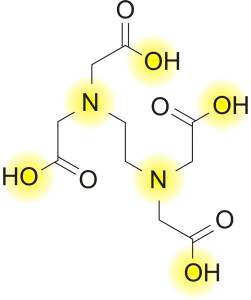
Kao standard otopina u kompleksometriji najčešće se koristi otopina etilendiamintetraoctene kiseline (C10H16N2O8 ili skraćeno EDTA). To je stabilna organska kiselina, koja disocira u četiri stupnja.
EDTA je polidentantni ligand koji posjeduje 6 koordinacijskih mjesta, dva preko dušikovih atoma i četiri preko kisikovih atoma iz acetatnih grupa. U reakciji s centralnim metalnim ionom može stvarati stabilne kelatne komplekse s 4, 5 ili 6 koordinacijskih mjesta.
Reakcija iona metala s EDTA uvijek je, bez obzira na njihov oksidacijski broj, u stehiometrijskom odnosu 1:1. Budući je EDTA slabo topljiva u vodi, kao reagens u kompleksometriji koristi se njena dinatrijeva sol (ili skraćeno Na2H2Y). Na2H2Y je primarni standard koji se na tržištu može naći pod različitim trgovačkim imenima (Komplekson III, Chelaton, Titriplex III, Versone itd.).
Reakcijski produkt MeY(n-4) naziva se kompleksnim ionom. Reakcija između metalnog iona i EDTA odvija se u točno određenom i konstantnom pH području. Tako su EDTA kompleksi s dvovalentnim metalnim ionima stabilni u lužnatom mediju, a s trovalentnim i četverovalentnim ionima u kiselom mediju.
U kompleksometriji, za određivanje završne točke titracije, koriste se indikatori koji s metalnim ionima u otopini reagiraju promjenom boje ili fluorescencijom. Takve indikatore nazivamo metalo indikatorima, a njihova najznačajnija grupa su metalokromni indikatori. Bit metalo indikatora jest u tome da s ionima metala kod određenog pH daju obojene komplekse pri čemu se boja nastalog kompleksa razlikuje od boje slobodnog indikatora. Tokom titracije ioni metala vežu se u stabilniji kompleks s EDTA, pa je boja otopine u ekvivalentnoj točki, jednaka boji slobodnog indikatora.
| Indikator | Boja kompleksa | Boja slobodnog indikatora | Kationi | pH |
|---|---|---|---|---|
| Sulfosalicilna kis. | crvena | svijetlo žuta | Fe3+ | 2.5 - 3 |
| PAN | ljubičastocrvena | svijetlo žuta | Al3+ | 4 |
| Mureksid | crvena | ljubičasta | Ca2+ | 12 |
| Eriokrom crno T | crvena | plava | Mg2+ + Ca2+ | 10 |
Literatura:
- Vogel, A. I., Quantitative Inorganic Analysis, Longman, London, 1975.
- Eškinja, I.; Šoljić, Z., Kvalitativna anorganska analiza, Tehnološki fakultet Zagreb, 1992.
- Šoljić, Z., Osnove kvantitativne kemijske analize, Tehnološki fakultet Sveučilišta u Zagrebu, Zagreb 1991.
- Princhard, F. E., Quality in the Analitycal Chemiistry Laboratory, John Wiley & Sons, New York, 1997.
- Skoog, D. A., West, D. M., Holler, F. J.: Osnove analitičke kemije, Školska knjiga, Zagreb, 1999.
- Filipović, I., Sabioncello, P., Laboratorijski priručnik, Tehnička knjiga, Zagreb, 1988.
Citiranje ove stranice:
Generalić, Eni. "Volumetrijske metode analize." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 29 Mar. 2025. <https://www.periodni.com/enig/volumetrijske_metode_analize.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni