KLORINITET I SLANOST MORA
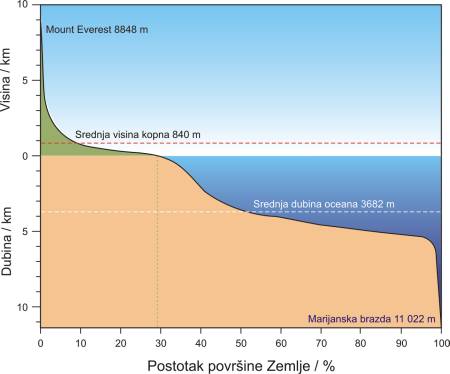
Veći dio Zemlje je pokriven s vodom. Od ukupne površine Zemlje, koja iznosi 510 100 000 km2, kopno prekriva 148 800 000 km2 (29.2 %) a svjetski oceani 361 300 000 km2 (70.8 %). Prosječna dubina mora iznosi 3711 m dok prosječna visina kopna iznosi samo 840 m iznad razine mora. Dakle, mora su prosječno mnogo dublja nego je kopno visoko. Reljef morskog dna također je mnogo nepravilniji nego što je onaj na kopnu, s brojnim velikim planinama i dubokim brazdama. Kad bi najvišu planinu na Zemlji (Mount Everest, visina 8848 m) stavili na dno Tihog oceana (Marijanska brazda, dubina 11 022 m) njen vrh bi se nalazio više od dva kilometra ispod površine. Zbog golemosti mora, negostoljubivosti njihove okoline i velike promjenjivosti od mjesta do mjesta kaže se da je bolje poznata površina Mjeseca nego topografija mora.
Po svom kemijskom sastavu more je nezasićena homogena otopina koja se sastoji od vode kao otapala (96.5 %), otopljene soli (3.5 %), manjih količina partikularne tvari, otopljenih plinova i organskih sastojaka. Tu se također dešava kontinuirana izmjena između mora i atmosfere te mora i morskog dna. Plinovi, tekućine i čestice u otopljenom i neotopljenom obliku neprekidno kruže morem.
Svaka litra oceana (a u oceanima je oko 1.34·1012 L) prosječno sadrži otprilike 34 g otopljenih soli (pri 10 °C i salinitetu od 35 ‰ gustoća morske vode iznosi 1.0270 kg/L). Do sada je utvrđeno preko 90 kemijskih elemenata u moru, a koji se mogu svrstati u dvije skupine: glavne elemente ili makrokonstituente i elemente u tragovima ili mikrokonstituente. Makrokonstituenti tvore 99.95 % otopljene tvari od čega samo na natrij i klor otpada više od 85 % ukupne količine.
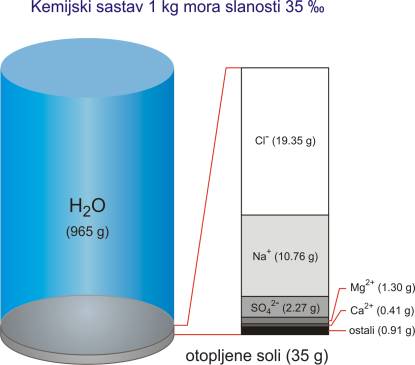
Ispitivanjem koncentracija najzastupljenijih soli u moru utvrđeno je da je njihov relativan odnos konstantan bez obzira na njihovu apsolutnu količinu. Ako poznajemo njihov odnos može se izračunati količina pojedine soli ili svih zajedno određivanjem samo jednog konstituenta. Udjeli najzastupljenijih vrsta u Standardnoj oceanskoj vodi, dani su u Tablici 1.
| Vrsta | Z | M / gmol-1 | X / 10-3 | X·Z / 10-3 | W |
|---|---|---|---|---|---|
| Cl- | -1 | 35.453(2) | 487.4839 | -487.4839 | 0.5503396 |
| Na+ | +1 | 22.989 769 28(2) | 418.8071 | 418.8071 | 0.3065958 |
| SO42- | -2 | 96.062 6(50) | 25.2152 | -50.4304 | 0.0771319 |
| Mg2+ | +2 | 24.305 0(6) | 47.1678 | 94.3356 | 0.0365055 |
| Ca2+ | +2 | 40.078(4) | 9.1823 | 18.3646 | 0.0117186 |
| K+ | +1 | 39.098 3(1) | 9.1159 | 9.1159 | 0.0113495 |
| HCO3- | -1 | 61.016 84(96) | 1.5340 | -1.5340 | 0.0029805 |
| Br- | -1 | 79.904(1) | 0.7520 | -0.7520 | 0.0019134 |
| B(OH)3 | 0 | 61.833 0(70) | 0.2807 | 0 | 0.0005527 |
| CO32- | -2 | 60.008 9(10) | 0.2134 | -0.4268 | 0.0004078 |
| Sr2+ | +2 | 87.62(1) | 0.0810 | 0.1620 | 0.0002260 |
| B(OH)4- | -1 | 78.840 4(70) | 0.0900 | -0.0900 | 0.0002259 |
| F- | -1 | 18.998 403 2(5) | 0.0610 | -0.0610 | 0.0000369 |
| CO2 | 0 | 44.009 5(9) | 0.0086 | 0 | 0.0000121 |
| OH- | -1 | 17.007 33(7) | 0.0071 | -0.0071 | 0.0000038 |
| UKUPNO | 1 000 | 0 | 1.0 |
Količina i međusobni odnosi elemenata u tragovima u moru su promjenjivi. Radi se o tvarima koje su organizmu potrebne u malim količinama (mikrohranjiva ili mikronutrienti), ali imaju veliku važnost za zdravlje i odvijanje životnih funkcija. Njihova prisutnost ili odsutnost često određuje hoće li se neki tip organizma razviti i opstati.
Salinitet
Najkarakterističnije svojstvo morske vode je njezin slani okus. Ukupna količina soli (izražena u gramima) otopljena u jednom kilogramu morske vode označava se kao slanost ili salinitet (‰). Slanost je od velike važnosti za fizikalna i biološka svojstva morske vode, odnosno njenog živog svijeta, a rezultat je dugotrajne interakcije procesa što su se odigravali i još uvijek traju između atmosfere, hidrosfere i biosfere. Jadransko more ima relativno visoku prosječnu slanost od 38.3 ‰, za razliku od prosječne slanosti oceana koja iznosi 35 ‰.
Vjerojatno ne postoji fizikalno svojstvo na koje slanost ne utječe. Promjena slanosti utječe na gustoću, osmozu, toplinski kapacitet, viskoznost, toplinsku i električnu vodljivost, refrakciju, brzinu širenja zvuka, površinsku napetost... Povećanjem slanosti također se snižava se temperatura ledišta a povisuje temperatura vrelišta mora.
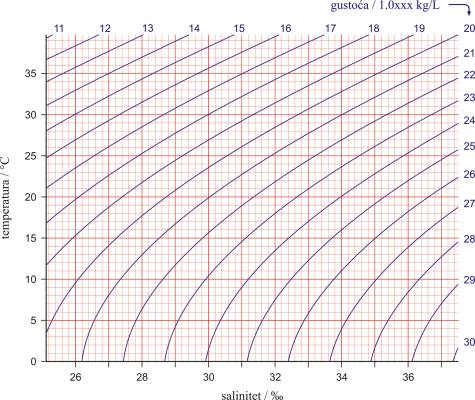
U praksi je uobičajeno prikazivati podatke o temperaturi i slanosti pomoću TS dijagrama (temperatura-slanost dijagrama) u kojem su ucrtane sigma-t linije (σt), koje predstavljaju gustoću (u kg/m3) umanjenu za 1000. Gustoća je jedan od najvažnijih parametara koji određuju dinamička svojstva mora i oceana i glavni je pokretač stalnih strujanja mora i oceana (u horizontalnom i vertikalnom smjeru).
Postoji mnogo načina da se odredi slanost mora ali najčešće upotrebljavani su:
- Gravimetrijsko određivanje (iz suhog ostatka)
- Volumetrijsko određivanje (iz kloriniteta)
- Konduktometrijsko određivanje (iz električne vodljivosti)
Određivanje saliniteta isparavanjem
Direktnim isparavanjem salinitet se određuje tako da se uzorak morske vode ispari a suhi ostatak zagrijava pri 480 °C do konstantne mase. Osim što tijekom zagrijavanja dolazi do gubitka hlapljivih tvari mjerenje otežava i velika hidroskopnost dobivenog taloga.
Danski fizičar Martin Knudsen (1871.-1949.), definirao je salinitet kao ukupnu količinu otopljene tvari u gramima koji se nalaze u jednom kilogramu morske vode, kad se svi karbonati pretvore u okside, brom i jod zamijenjene klorom, a sva se organska materija oksidira.
Određivanje kloriniteta
Nažalost, direktno određivanje saliniteta nije bilo praktično pa se, temeljem ideje o stalnom omjeru otopljenih komponenti morske vode, došlo na ideju da se mjeri samo jedan parametar - klorinitet, odnosno sadržaj klorida, bromida i jodida u morskoj vodi, i iz njega izračuna salinitet. Mjerenjem saliniteta i kloriniteta u uzorcima mora iz različitih dijelova svijeta Knudsen je, 1889., došao do empirijske formule za određivanje saliniteta:
Ova formula koristila se do 1962., kada je Zajedničko vijeće za oceanografske tablice i standarde (JPOTS, Joint Panel for Oceanographic Tables and Standards) odredilo novu konstantu proporcionalnosti u Knudsenovoj formuli
Gornja jednadžba ne vrijedi kod jako razrijeđenih uzoraka mora tj. tamo gdje je salinitet izrazito nizak (npr. Baltičkog mora ili ušća rijeka).
Mjerenje vodljivosti
U međuvremenu, razvoj uređaja za mjerenje električne vodljivosti doveo je do brze, jeftine i precizne metode za određivanja slanosti morske vode. Obzirom da vodljivost morske vode ovisi o količini otopljenih tvari, JPOTS je, 1978., definirano Skalu praktičnog saliniteta (Practical Salinity Scale 1978, PSS-78) koji je i danas najčešći način za određivanje saliniteta morske vode.
Promjenom tehnike određivanja promijenio se i standard pa je trenutno međunarodno prihvaćeni standard za određivanje Praktičnog saliniteta IAPSO Standardna morska voda (IAPSO Standard Seawater) koju proizvodi OSIL (Ocean Scientific International Limited).
Praktični salinitet (praktična slanost), označen kao SP, definiran je preko K15, odnosno odnosa električne vodljivosti uzorka mora pri 15 °C i tlaku od jedne standardne atmosfere i otopine kalijevog klorida (KCl) u kojoj je maseni udio KCl točno 0.032 4356 (32.4356 g KCl otopljeno je u 1 kg otopine) pri istom tlaku i temperaturi. Po definiciji, K15 iznosi točno 1 kada je praktični salinitet jednak 35 (pri gornjim uvjetima vodljivost obje otopine je 429.14 S/m). Praktični salinitet definiran je slijedećom jednadžbom koja vrijedi za slanosti od 2 do 42:
Kod mjerenja pri temperaturama i tlakovima (dubinama) različitim od standardnih računa se odnos vodljivosti R koji se može prikazati kao produkt tri faktora označena s Rp, Rt i rt:
Kako se može vidjeti iz gornje jednadžbe, Rt se za svaki uzorak može izraziti preko R (koji se mjeri) i Rp i rt (koji se mogu izračunati). Za svaku temperaturu različitu od t68 = 15 °C Praktični salinitet dan je kao funkcija od Rt (pri čemu je k = 0.0162). Pri temperaturi t68 = 15 °C Rt postaje K15.
Oznaka t68 govori nam da su sve temperature na IPTS-68 skali. Kako bi se koristili termometri koji su umjereni prema međunarodnoj temperaturnoj skali iz 1990 (ITS-90) potrebno je prvo konvertirati temperaturu u t68 koristeći faktor t68 = 1.00024·t90.
Praktični salinitet nema jedinicu iako mu se ponekad (pogrešno) pridružuje PSU (Practical Salinity Unit) kako bi bolje izgledao. Ali, morate biti svjesni da ni "obični" salinitet nema jedinicu - promil znači "puta jedan kroz tisuću" (‰ = *0.001), odnosno 35 ‰ isto je što i 0.035. To je očevidno već iz same definicije saliniteta koja kaže da je salinitet ukupna količina soli, izražena u gramima (1 g = 0.001 kg), otopljena u jednom kilogramu morske vode.
Određivanje kloriniteta Knudsenovom metodom
Kako se određivala slanost u laboratorijima opremljenim specijalnom Knudsenovom pipetom, Knudsenovom biretom i Tablicama te Normalnom vodom
Klorinitet je definiran kao ukupna količina halida (klorida, bromida i jodida) u 1 kg mora, a da su pri tome jodid i bromid zamijenjeni ekvivalentnom količinom klorida. Ovom definicijom uveden je jedan ekvivalent koji ovisi o promjenama atomskih masa. Zbog toga je klorinitet danas definiran kao masa čistog srebra potrebna da se istalože svi kloridi, bromidi i jodidi pomnožena s 0.37285233. Na ovaj način je klorinitet učinjen neovisnim o promjenama atomskih masa.
Volumetrijsko određivanje halida Mohrovom metodom dugo godina je bila uobičajena metoda za rutinsko određivanje količine soli u uzorcima morske vode. Mohrova metoda jedna je od najstarijih metoda titracije - uveo ju je 1856. njemački kemičar Karl Friedrich Mohr (1806.-1879.). Titracija se vrši standard otopinom srebrovog nitrata (AgNO3) uz kalijev kromat (K2CrO4) kao indikator.
pri tome se uz AgCl talože još i AgBr i AgI.
Problem kod Mhorove titracije je u tome što srebrov nitrat nije primarni standard. Kako bi se ovo izbjeglo definirana je standardna Normalna voda (s velikim početnim slovom) stalnog sastava i s točno određenim klorinitetom (oko 19.38 ‰). Ova voda je potom korištena za standardizaciju otopine srebrova nitrata. Na taj način sva određivanja kloriniteta referirala su se na isti standard što je omogućilo da svi rezultati budu usporedivi.
Normalna voda (Eau de mer Normale ili Copenhagen Normal Water) nabavlja se u Hidrografskom laboratoriju u Kopenhagenu (Danska).
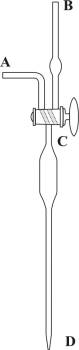
Knudsenova pipeta
Knudsenova pipeta s automatskom nulom (Slika 4.) omogućava brzo i točno pipetiranje stalnog volumena tekućine, obično oko 15 mL. Na njenom vrhu nalazi se dvosmjerni ventil C koji možete uspostaviti protok između tijela pipeta i jedne od grana A ili B, ili izolirati tijelo pipete od obje grane. Usisavanjem kroz granu B pipeta se puni tekućinom i okretanjem ventila se zatvori. Pipeta se ispušta otvaranjem ventila prema grani A (kako bi atmosferski zrak mogao ulazit u pipetu). Pražnjenje traje oko 30 sekundi. Prije prvog korištenja nova pipeta kalibrira se destiliranom vodom.
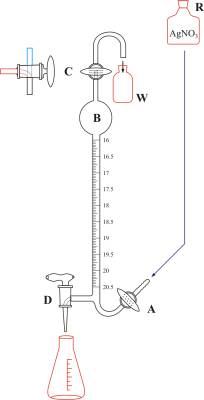
Knudsenova bireta
Knudsenova bireta s automatskom nulom (Slika 5.) osmišljena je kako bi se i pri rutinskim terenskim analizama u brodskom laboratoriju ostvarila visoka točnost mjerenja. Bireta se puni otopinom srebrovog nitrata iz rezervoara R smještenog iznad birete otvaranjem ventila A. Kada otopina pređe trokraki ventil C prekine se dotok otopine (zatvaranjem ventila A). Eventualni višak otopine hvata se u posudu W. Okrene se trokraki ventil C, koji ujedno označava nulu na skali, kako bi atmosferski zrak mogao ulaziti u biretu. Budući da većina oceanskih uzoraka leži u relativno uskom rasponu kloriniteta, bireta je osmišljena tako da se većina njenog kapaciteta nalazi u proširenju na vrhu (B). To omogućava da titracija bude brza (brzim ispuštanjem sadržaja proširenja B) i smanjuje pogrešku nastalu cijeđenjem otopine niz stjenku birete. Svaki mililitar podijeljen je na dvadeset dijelova (tzv. podjela na dvostruke mililitre Knudsenove birete) čime se postiže velika preciznost mjerenja (skala se lako očitava do preciznosti od 0.005 mL). Od 0 do 16 bireta nema podjelu, ona obično počinje od 16 i ide do 20.5 ili 21.5. Jedan dvostruki mililitar na skali Knudsenove birete odgovara jednom promilu klorida u uzorku. Ova bireta se može koristiti za titriranje vode svih oceana i svih mora, s izuzetkom onih vrlo niske slanosti (npr. Baltičkog mora) i ušća rijeka, koji zahtijevaju korištenje običnih bireta.
Postupak mjerenja
Prije početka jedne serije titracija proba morske vode treba utvrditi titar (titar je masa titrirane tvari koja je ekvivalentna 1 mL otopine) pripremljene otopine AgNO3 (otopina je pripremljena otapanjem 37.11 g AgNO3 u 1 L destilirane vode). Titar se odredi pomoću Normalne vode, čiji je klorinitet točno poznat (na treću decimalu) a iznosi oko 19.38 promila klorida. Razlika koja se dobije pri titriranju Normalne vode prikazuje se kao α vrijednost. Ona može biti pozitivna ili negativna što ovisi o tome da li je utrošak srebro nitrata po 1 mg klorida veći ili manji od 1 dvostruki ml pri titriranju Normalne vode. Dobivenu vrijednost za klorinitet, na temelju dobivene vrijednosti za α, korigiramo pomoću Knudsenovih hidrografskih tablica. Nakon što smo ispravili dobivene vrijednosti kloriniteta u prave vrijednosti izvadimo vrijednost za slanost i gustoću iz hidrografskih tablica.
Normalna voda služi kao osnova za utvrđivanje ekvivalentne količine utrošenog AgNO3 koja odgovara 19.381 ‰ klorida. Tako da 1 dvostruki ml na Knudsenovoj bireti utrošenog AgNO3 odgovara 1 ‰ klorida. Na ovaj način dobijemo otopinu AgNO3, čiji titar treba da približno odgovara jednom promilu klorida. K2CrO4 služi kao indikator kako bi se utvrdila točka u kojoj se sav klorid istaložio u obliku teško topljivog srebro klorida, jer se upravo u tom trenutku počinje taložiti Ag2CrO4 što se vidi u promjeni boje otopine od žute u svjetlo smeđu. Ova promjena boje osniva se na razlici produkta topljivosti AgCl i Ag2CrO4.
Prikaz rezultata
Možemo ukratko prikazati kako teče način određivanja slanosti:
| Klorinitet Normalne vode (očitan s naljepnice na etalonu) | N = 19.381 ‰ | |
| Očitanje birete kod titracije Normalne vode | A = 19.515 | |
| Razlika (N - A) | α = -0.134 | |
| Očitanje birete kod titracije uzorka mora | a = 19.62 | |
| Korekcija za α iz Hidrografskih tablica | k = -0.14 | |
| Klorinitet uzorka mora | Cl = 19.48 ‰ | |
| Na temelju dobivene vrijednosti za klorinitet nalazimo u Tablicama podatke za S i σt | S = 35.19 ‰ σt = 28.28 |
| Datum | Temperatura | Broj mjerenja | čitanje birete | Cl / ‰ | S / ‰ | Primjedba |
|---|---|---|---|---|---|---|
| 14/11 | 23 °C | 20 | 19.03 | 19.08 | 34.47 | α = +0.040 |
| 21 | 19.07 | 19.12 | 34.54 | |||
| 22 | 19.14 | 19.18 | 34.65 | |||
| 23 | 19.165 | 19.205 | 34.70 | |||
| 23 °C | Normalna voda | 19.345 | 19.12 | 34.54 | P16:19.380 | |
| 24 | 19.135 | 19.175 | 34.64 | α = +0.035 | ||
| 25 | 19.125 | 19.165 | 34.62 | |||
| 26 | 19.16 | 19.20 | 34.69 | |||
Bibliografija:
- "United Nations Atlas of the Oceans." UN-Oceans. 3 Aug. 2011. <http://www.oceansatlas.com>
- "OSIL Seawater Standards." Ocean Scientific International ltd.. 3 Aug. 2011. <http://www.osil.co.uk/Products/SeawaterStandards/tabid/113/agentType/ViewType/PropertyTypeID/25/Default.aspx>
- IOC, SCOR and IAPSO, The international thermodynamic equation of seawater - 2010: Calculation and use of thermodynamic properties. Intergovernmental Oceanographic Commission, Manuals and Guides No. 56, UNESCO, 2010.
- J.P. Rilej, G. Skirrow, Chemical Oceanography, Vol. 1-7, Academic Press, London, 1975.
- E. Merian, M. Anke, M. Inhat, M. Stoeppler, Elements and their Compounds in the Environment, Wiley VHC, New York, 2004.
- Helge Thomsen, Instructions pratiques sur la détermination de la salinité de l'eau de mer par la méthode de titrage de Mohr-Knudsen, Bulletin de l'Institut Océanographique, No. 1047, 1954
Citiranje ove stranice:
Generalić, Eni. "Klorinitet i slanost mora." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/klorinitet_i_slanost_mora.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
