OZONSKI OMOTAČ NIJE ŠTIT
VEĆ OSTATAK ZAŠTITE OD UV ZRAČENJA
Sažetak: Svi govore kako ozonski omotač štiti Zemlju od Sunčevog opasnog zračenja ali to nije točno. Ozon nema štit kojim odbija UV zračenje - on se žrtvuje za našu zaštitu. Koliko god debeo bio sloj ozona on će jednostavno ispariti kad ga svjetlost obasja. Kako bi površina bila zaštićena u svakom trenutku mora nastati toliko ozona koliko je UV-B fotona u zraci svjetlosti. Količina ozona na putu fotona ovisit će prvenstveno o količini atoma kisika koju svjetlost proizvede fotodisocijacijom. Fotodisocijacija molekule kisika pokretačka je snaga ovog ciklusa. Što je Sunce toplije, odnosno što proizvodi više fotona s valnom duljinom manjom od 240 nm, zaštita površine Zemlje od UV zračenja je bolja. Sam ozonski omotač predstavlja "negativ" zaštite od UV zračenja. Sačinjen je od molekula ozona koje UV fotoni nisu uspjeli pogoditi i onih koje nisu disocirale iako su pogođene. I jedno i drugo ovisi samo o vjerojatnosti da se desi.
Ključne riječi: ozonski omotač; UV zračenje; zaštita; kisikov atom
Uvod
"Engleski fizičar Sidney Chapman formulirao je 1930. prvu fotokemijsku teoriju formiranja i razgradnje ozona u atmosferi. Ova teorija, koja opisuje kako Sunčeva svjetlost pretvara jednu formu kisika u drugu, objašnjava zašto se između 15 i 50 km nalaze velike količine ozona, nazvane ozonski omotač. Kasnija mjerenja su, međutim, pokazala značajna odstupanja od Chapmanove teorije. Izračunati sadržaj ozona bio je znatno viši od onih dobivenih mjerenjem. Dakle, morale su postojati i druge kemijske reakcije koje uzrokuju smanjenje sadržaja ozona u atmosferi. Nekoliko godina kasnije, belgijanac Marcel Nicolet objasnio je kako se razgradnja ozona pojačava u prisutnosti radikala vodika, OH i HO2.
Znanstvenik koji je napravio sljedeći korak prema dubljem razumijevanju kemije ozonskog sloja je Paul Crutzen. Godine 1970. pokazao je da dušikovi oksidi NO i NO2 reagiraju katalitički (bez da se sami troše) s ozonom, čime se ubrzava stopa smanjenja sadržaja ozona.
Sljedeći skok u našem poznavanju kemije ozona napravljen je 1974. godine, kada su Mario Molina i Sherwood Rowland ... "[1]
Prekinut ćemo prikaz razvoja atmosferske kemije na ovom mjestu. Kako bi pojednostavnili problem vratit ćemo se nekoliko stoljeća u prošlost, u predindustrijsko vrijeme. I onda je, kao i danas, atmosfera štitila površinu od UV zračenja ali je utjecaj čovjeka na nju bio minimalan. Promijenit ćemo i kut gledanja. Umjesto da atmosferu i procese u njoj gledamo iz perspektive čovjeka, s površine, pratit ćemo sudbinu fotona koji sa Sunca stižu na Zemlju.
U ovom radu pokušat ćemo na vrlo jednostavan način objasniti kako atmosfera štiti površinu i tko joj u tome pomaže a tko odmaže. Kao referentnu literaturu koristit ćemo Atkinsovu Fizikalnu kemiju. Pa započnimo sa Chapmanovim modelom sa stranice 922.[2]
Chapmanov model objašnjava formiranje i razgradnju ozona u atmosferi koja sadrži samo O2:
Inicijacija:
O2 + hν → O + O
185 nm < λ < 220 nm
Propagacija:
O + O2 + M → O3 + M*
ΔrH = -106.6 kJ/mol
O3 + hν → O2 + O
210 nm < λ < 300 nm
Terminacija:
O + O3 → O2 + O2
ΔrH = -391.9 kJ/mol
O + O + M → O2 + M*
Model prikazuje veću koncentraciju ozona od stvarne u stratosferi jer i tragovi drugih vrsta X mogu katalizirati terminaciju ozona i atoma kisika što je prikazano reakcijama
Katalizator X može biti H, OH, NO ili Cl.
Sunčevo elektromagnetsko zračenje pokretačka je snaga Chapmanovog ciklusa. Elektromagnetsko zračenje karakterizirano je svojom valnom duljinom λ i frekvencijom ν koji se odnose prema relaciji λ = c/ν, gdje c predstavlja brzinu svjetlosti. Valna teorija obično se koristi kod izučavanja širenja elektromagnetskog zračenja a kad dolazi do interakcije zračenja i materije bolje je elektromagnetsko zračenje opisati kao snop fotona s energijom hν, gdje h predstavlja fundamentalnu konstantu poznatu kao Planckova konstanta.
Životni put atoma kisika
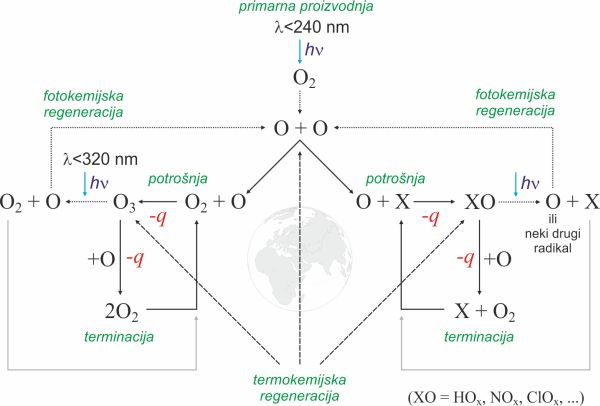
Kako kemijom mezosfere i stratosfere dominiraju reakcije koje uključuju kisikov atom, modificirali smo Chapmanov model tako da bolje odgovara putovima konverzije atoma kisika. Propagaciju u Chapmanovom modelu zamijenili smo s dva nova koraka, potrošnjom i fotokemijskom regeneracijom atoma kisika. Shema ovog ciklusa prikazana je na slici 1.
Slika 1. Životni put atoma kisika. Lijeva strana ciklusa predstavlja Chapmanov model dok su na desnoj strani reakcije atoma kisika s ostalim konstituentima atmosfere. Na slici nisu prikazane reakcije nego samo putovi konverzije atoma kisika. Simbol hν predstavlja energiju apsorbiranog fotona a -q predstavlja energiju oslobođenu kemijskom reakcijom. → Preuzimanje slike visoke kvalitete
Životni put atoma kisika može se podijeliti u nekoliko etapa
- 1. Primarna proizvodnja
- Ovo je pokretačka snaga ovog ciklusa. Fotoni s valnom duljinom manjom od 240 nm cijepaju molekulu kisika pri čemu nastaju dva reaktivna atoma kisika. Dokle god Sunčeva svjetlost obasjava atmosferu novi se atomi kisika pumpaju u ciklus. Disocijacija molekule kisika kojom nastaju atomi kisika endotermna je reakcija koja energiju dobiva od UV fotona.
- 2. Potrošnja
- Atomi kisika reagiraju s konstituentima atmosfere stvarajući ili mete za nadolazeće fotone ili nove radikale. Ciklus ozona prikazan je odvojeno samo zbog njegove važnosti. Reakcije u kojima nastaju stabilni spojeve ili spojevi koji se ne mogu fotolizom razložiti nisu dio ovog ciklusa. Reakcije atoma kisika s drugim molekulama su egzotermne (oslobađaju energiju).
- 3. Fotokemijska regeneracija
- Produkti nastali reakcijom s atomima kisika automatski postaju mete za novi snop fotona. Njihovom fotolizom jedan atom kisika vraća se nazad u ciklus. Minimalna valna duljina fotona potrebna za fotolizu ovisi o nastalom spoju - za fotolizu ozona je 320 nm. Ove reakcije su endotermne i za njihovo odvijanje potrebna je energija fotona.
- 4. Terminacija
- Reakcijama prvenstveno s ozonom i dušikovim oksidima te nekim drugim spojevima (među koje spadaju i kemikalije koje u atmosferu ispušta čovjek) atomi kisika pretvaraju se u molekularni kisik i izlaze iz ciklusa. Terminacija atoma kisika po iznosu mora biti jednaka primarnoj produkciji kako bi se održala ravnoteža sustava. Terminacijom (ako nije fotokemijska) također se oslobađa toplina.
- 5. Termokemijske reakcije
- Termokemijske reakcije ne doprinose puno dnevnoj proizvodnji atoma kisika ali su odgovorne za relaksaciju atmosfere tijekom noći. Isto je i s termokemijskom regeneracijom i terminacijom ozona.
Kako Sunce utječe na ovaj ciklus?
Svi fotoni koji pokreću ovaj ciklus vode porijeklo sa Sunca. Za naše svrhe dobra je aproksimacija prikazati Sunce kao crno tijelo zagrijano na 5778 K.[3] Koristeći dobro poznati Planckov zakon za zračenje crnog tijela, u kojem k predstavlja Boltzmannovu konstantu, (Atkins, p.295)
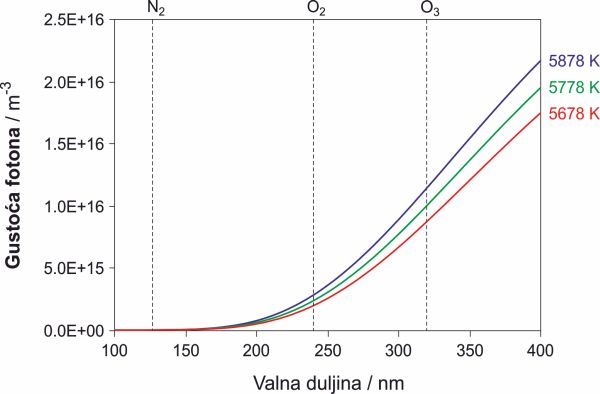
i energiju fotona, E = λ/hc, izračunali smo raspodjelu broja fotona Np po valnim duljinama λ. Kako bi ilustrirali kako se mijenja raspodjela energije u UV području isto smo učinili i uz pretpostavku da je Sunce 100 K toplije odnosno hladnije. Rezultati su prikazani na slici 2. Iz slike je vidljivo da porastom temperature nagib krivulje postaje sve strmiji, odnosno da promjena temperature crnog tijela ne utječe jednako na sve fotone.[4]
Slika 2. Spektralna raspodjela fotona pri različitim temperaturama. Raspodjela broja fotona po valnim duljinama u UV području (od 100 nm do 400 nm) koju zrači crno tijelo zagrijano na 5678 K, 5778 K i 5878 K. Za istu promjenu temperature promjena nagiba krivulje veća je za toplije tijelo. → Preuzimanje slike visoke kvalitete
Odnos UV-C i UV-B zračenja u Sunčevom spektru nije 1:1. Ako tablično prikažemo odnose fotona koji u Chapmanovom modelu mogu fotodisocirati molekulu kisika (UV-C) odnosno ozona (UV-B) možemo primijetiti nešto interesantno. Čak i kad bi se svi fotoni s valnom duljinom manjom od 240 nm potrošili na cijepanje molekule kisika i kad bi svi tako nastali atomi kisika dali po jednu molekulu ozona, još uvijek bi bilo 2.8 puta više fotona u UV-B zračenju nego što je molekula ozona koje ih mogu apsorbirati.
Tablica 1. Odnosi fotona u Chapmanovom modelu. U prvoj koloni je temperatura crnog tijela, u drugoj su zbrojeni svi fotoni koji mogu fotolizirati O2 (185 nm < λ < 220 nm) a u trećoj su oni koji mogu fotolizirat O3. Njihov odnos dan je u koloni 4. Posljednja kolona kaže koliko se dobiveni odnosi razlikuju od onog dobivenog za crno tijelo zagrijano na 5778 K.
| T / K | ∑Np(O2) (185 nmλ<220 nm) |
∑Np(O3) (210 nmλ<300 nm) |
Np(O2)/Np(O3) | razlika % |
|---|---|---|---|---|
| 5678 | 1.25E+15 | 7.40E+15 | 0.1690 | -5.19 |
| 5778 | 1.54E+15 | 8.63E+15 | 0.1783 | 0,00 |
| 5878 | 1.88E+15 | 1.00E+16 | 0.1877 | 5.27 |
Promatrajući samo fotone koji su se uputili sa Sunca možemo zaključiti da:
- Svaki foton Zemlju posjeti samo jednom i nikad više.
- Što je Sunce toplije, odnosno što proizvodi više fotona s valnom duljinom manjom od 240 nm koji pokreću kisikov ciklus, zaštita površine Zemlje od UV zračenja je bolja.
- Skoro tri puta više kisikovih atoma nastaje fotokemijskom regeneracijom nego primarnom produkcijom.
Citiranje ove stranice:
Generalić, Eni. "Prvi dio: Ozonski omotač nije štit već ostatak zaštite od UV zračenja." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 9 Apr. 2025. <https://www.periodni.com/enig/ozonski_omotac_nije_stit.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni