Cu
Cuprum
COBRE
ELEMENTOS DE TRANSICIÓN: GRUPO DEL COBRE
| Número atómico: | 29 |
| Grupo: | 11 |
| Periodo: | 4 |
| Configuración electrónica: | [Ar] 3d10 4s1 |
| Estados de oxidación: | +1 +2 |
| Electronegatividad: | 1.9 |
| Radio atómico / pm: | 127.8 |
| Masa atómica relativa: | 63.546(3) |
El cobre era conocido en la prehistoria. Su nombre proviene de la isla de Chipre, donde existía en la antigüedad una gran producción de objetos de cobre. Es uno de los metales de mayor uso, de apariencia metálica y color pardo rojizo. Se encuentra en la naturaleza, principalmente, combinado con el azufre; en estado nativo se presenta con gran rareza. El cobre puro se emplea en electrotécnica debido a su alta conductividad eléctrica y térmica. Tienen gran aplicación sus aleaciones con estaño y zinc (latón, bronce).
| Densidad / g dm-3: | 8960 | (293 K) |
| 7940 | (m.p.) | |
| Volumen molar / cm3mol-1: | 7.09 | (293 K) |
| 8.00 | (m.p.) | |
| Resistencia eléctrica / µΩcm: | 1.673 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 401 |
| Punto de fusión / °C: | 1084.62 |
| Punto de ebullición / °C: | 2562 |
| Calor de fusión / kJ mol-1: | 13 |
| Calor de vaporización / kJ mol-1: | 306.7 |
| Calor de atomización / kJ mol-1: | 337.15 |
| Primera energía de ionización / kJ mol-1: | 745.49 |
| Segunda energía de ionización / kJ mol-1: | 1957.93 |
| Tercera energía de ionización / kJ mol-1: | 3554.64 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 75 |
| en los océanos / ppm: | 0.003 |
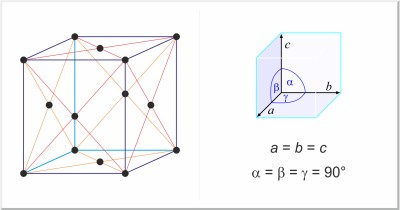
| Estructura cristalina: | cúbica centrada en las caras |
| Dimensiones de la celda unidad / pm: | a=361.47 |
| Grupo espacial: | Fm3m |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 63Cu | 62.929601(2) | 69.17(3) |
| 65Cu | 64.927794(2) | 30.83(3) |
| Semirreacción | Eo / V | |
|---|---|---|
| Cu2+ + 2e- → Cu(s) | +0.337 | |
| Cu2+ + e- → Cu+ | +0.153 | |
| Cu+ + e- → Cu(s) | +0.521 | |
| HCuO2- + 3H+ + e- → Cu+ + 2H2O | +1.73 | |
| CuO22- + 4H+ + e- → Cu+ + 2H2O | +2.51 | |
| HCuO2- + 3H+ + 2e- → Cu(s) + 2H2O | +1.13 | |
| CuO22- + 4H+ + 2e- → Cu(s) + 2H2O | +1.52 | |
| 2Cu2+ + H2O + 2e- → Cu2O(s) + 2H+ | +0.20 | |
| 2HCuO2- + 4H+ + 2e- → Cu2O(s) + 3H2O | +1.78 | |
| 2CuO22- + 6H+ + 2e- → Cu2O(s) + 3H2O | +2.56 | |
| CuO + 2H+ + e- → Cu+ + H2O | +0.62 | |
| Cu2+ + Br- + e- → CuBr(s) | +0.64 | |
| Cu2+ + Cl- + e- → CuCl(s) | +0.54 | |
| Cu2+ + I- + e- → CuI(s) | +0.86 | |
| CuI(s) + e- → Cu(s) + I- | - 0.185 | |
| Cu(NH3)42+ + e- → Cu(NH3)2+ + 2NH3 | - 0.01 | |
| Cu(NH3)2+ + e- → Cu(s) + 2NH3 | - 0.12 | |
| Cu(NH3)42+ + 2e- → Cu(s) + 4NH3 | - 0.07 |
Citación de esta página:
Generalic, Eni. "Cobre." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/es/cu.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
Copyright © 1998-2025 by Eni Generalic. Todos los derechos reservados. | Bibliografía | Disclaimer
