HIDRÓGENO
| Número atómico: | 1 |
| Grupo: | 1 |
| Periodo: | 1 |
| Configuración electrónica: | 1s1 |
| Estados de oxidación: | -1 +1 |
| Electronegatividad: | 2.2 |
| Radio atómico / pm: | 37.3 |
| Masa atómica relativa: | [1.007 84, 1.008 11] |
El hidrógeno fue reconocido como un elemento químico en 1776 por químico británico Henry Cavendish. Su nombre deriva del greco-latín 'hidrogenium', que significa generador de agua. El hidrógeno es el elemento más abundante del universo, suponiendo más del 75% en masa y más del 90% en número de átomos. En la industria química y petroquímica se requieren grandes cantidades de H2. La aplicación principal del H2 es para el procesamiento (refinado) de combustibles fósiles, y en la síntesis de amoníaco. Ya que en su combustión se produce sólo agua y ningún otro tipo de emisión, constituye una fuente de energía ecológica y con un prometedor futuro. El 3/4 del H2 se produce a partir de los procesos petroquímicos. A escala laboratorio, el hidrógeno se puede preparar mediante la reacción de ácidos diluidos con zinc.
| Densidad / g dm-3: | 76.0 | (sólido, 11 K) |
| 70.8 | (líquido, b.p.) | |
| 0.08988 | (gaseoso, 273 K) | |
| Volumen molar / cm3mol-1: | 13.26 | (sólido, 11 K) |
| 14.24 | (líquido, b.p.) | |
| 22423.54 | (gaseoso, 273 K) | |
| Resistencia eléctrica / µΩcm: | - | (20 °C) |
| Conductividad térmica / W m-1K-1: | 0.183 |
| Punto de fusión / °C: | -259.34 |
| Punto de ebullición / °C: | 252.87 |
| Calor de fusión / kJ mol-1: | 0.12 |
| Calor de vaporización / kJ mol-1: | 0.46 |
| Calor de atomización / kJ mol-1: | 216.003 |
| Primera energía de ionización / kJ mol-1: | 1312.06 |
| Segunda energía de ionización / kJ mol-1: | - |
| Tercera energía de ionización / kJ mol-1: | - |
| en la atmósfera / ppm: | 0.53 |
| en la corteza terrestre / ppm: | 1400 |
| en los océanos / ppm: | (H2O) |
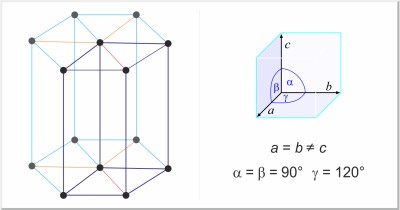
| Estructura cristalina: | hexagonal |
| Dimensiones de la celda unidad / pm: | a=377.6, c=616.2 |
| Grupo espacial: | P63/mmc |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 1H | 1.007825032(1) | 99.985(1) |
| 2H | 2.014101778(1) | 0.015(1) |
| 3H | 3.016049268(1) | * |
| Semirreacción | Eo / V | |
|---|---|---|
| 2H+ + 2e- → H2(g) | 0.000 | |
| 2H+ + 2e- → H2(g) | - 0.41 | ([H+] = 10-7 mol dm-3) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HCl) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HClO4) |
| 2H2O + 2e- → H2(g) + 2OH- | - 0.83 | |
| H2O2 + 2H+ + 2e- → 2H2O | +1.77 | |
| HO2- + H2O + 2e- → 3OH- | +0.88 | |
| H2(g) + 2e- → 2H- | - 2.25 |
Citación de esta página:
Generalic, Eni. "Hidrógeno." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/es/h.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
