TITANE
ÉLÉMENT de TRANSITION: GROUPE du TITANE
| Nombre atomique: | 22 |
| Groupe: | 4 |
| Période: | 4 |
| Configuration électronique: | [Ar] 3d2 4s2 |
| Nombre d'oxydation: | +2 +3 +4 |
| Électronégativité: | 1.54 |
| Rayon atomique / pm: | 144.8 |
| Masse atomique relatives: | 47.867(1) |
Le titane a été découvert par William Gregor (GB) en 1791. Étymologie du nom: vient de Titans, fils de la Terre et du ciel dans la mythologie grecque. Le titane est un métal brillant, gris foncé. Sous forme de poudre il brûle dans l'air. Il peut être poli très fortement et il ne se ternit pratiquement pas. Il ne réagit pas avec les bases et la plupart des acides. Le titane est présent dans les minerais d'ilménite (FeTiO3), de rutile (TiO2) , de fer. On le produit en chauffant l'oxyde de titane avec du carbone et du dichlore pour obtenir du TiCl4 qui est ensuite chauffé avec du magnésium gazeux dans une atmosphère d'argon. Du fait que le titane est dur et qu'il résiste aux acides, on l'utilise dans de nombreux alliages. L'oxyde de titane (TiO2), pigment blanc qui couvre très bien une surface, est utilisé entre autre, pour la peinture, le caoutchouc et le papier.
| Densité / g dm-3: | 4540 | (293 K) |
| 4110 | (m.p.) | |
| Volume molaire / cm3mol-1: | 10.54 | (293 K) |
| 11.65 | (m.p.) | |
| Résistivité électrique / µΩcm: | 42 | (20 °C) |
| Conductibilité thermique / W m-1K-1: | 21.9 |
| Point de fusion / °C: | 1668 |
| Point d'ébullition / °C: | 3287 |
| Enthalpie de fusion / kJ mol-1: | 20.9 |
| Enthalpie d'évaporation / kJ mol-1: | 425.5 |
| Chaleur d'atomisation / kJ mol-1: | 467.14 |
| Energie de première ionisation / kJ mol-1: | 658.82 |
| Energie de deuxième ionisation / kJ mol-1: | 1309.85 |
| Energie de troisième ionisation / kJ mol-1: | 2652.56 |
| dans l'atmosphère / ppm: | - |
| dans la croute terrestre / ppm: | 5400 |
| dans les océans / ppm: | 0.001 |
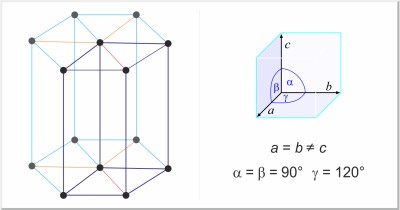
| Structure cristalline: | hexagonal |
| Dimension de la cellule unitaire / pm: | a=295.11, c=468.43 |
| Groupe d'espace: | P63/mmc |
| Isotope | Masse atomique relatives | Pourcentage massique (%) |
|---|---|---|
| 46Ti | 45.952629(1) | 8.0(1) |
| 47Ti | 46.951764(1) | 7.3(1) |
| 48Ti | 47.947947(1) | 73.8(1) |
| 49Ti | 48.947871(1) | 5.5(1) |
| 50Ti | 49.944792(1) | 5.4(1) |
| Demi-réaction | Eo / V | |
|---|---|---|
| TiIV + e- → TiIII | - 0.092 | (1 mol dm-3 HCl) |
| TiIV + 4e- → Ti(s) | - 0.88 | (1 mol dm-3 HCl) |
| Ti3+ + e- → Ti2+ | - 0.369 | |
| Ti2+ + 2e- → Ti(s) | - 1.630 | |
| TiO22+ + H+ + 4e- → HTiO2- | +1.303 | |
| TiO22+ + 2H+ + 2e- → TiO2+ + H2O | +1.800 | |
| TiO2(s) + 4H+ + e- → Ti3+ + H2O | - 0.666 | |
| TiO2(s) + 4H+ + 2e- → Ti2+ + H2O | - 0.502 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.099 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.04 | (1 mol dm-3 H2SO4) |
| TiO2+ + 2H+ + 2e- → Ti2+ + H2O | - 0.135 | |
| HTiO2- + 5H+ + 2e- → Ti2+ + 3H2O | +0.362 | |
| TiF62- + 4e- → Ti(s) + 6F- | - 1.19 |
| 21 Scandium | ← | 22 Titane | → | 23 Vanadium |
Citation de cette page:
Generalic, Eni. "Titane." EniG. Tableau périodique des éléments. KTF-Split, 13 Feb. 2025. Web. 31 Mar. 2025. <https://www.periodni.com/fr/ti.html>.
Tableaux et articles
- Tableau périodique
- Home
- Forme courte du tableau périodique
- Forme longue du tableau périodique
- History of the Periodic table of elements
- Impression du tableau périodique
- Configuration électronique des éléments
- Liste alphabétique des éléments chimiques
- Naming of elements of atomic numbers greater than 100
- ASCII Tableau périodique
- Calculatrices online
- Calculatrice scientifique pour chimiste
- Calculatrice lois de gaz
- Calculateur de masse molaire
- Convertir angle
- Convertisseur chiffres romains
- Convertisseur systèmes numériques
- Préparation des solutions
- Étiquetage des conteneurs chimiques
- Calculateur de nombres d'oxydation
- ARS methode
- Méthode du changement des nombres d'oxydation
- Méthode ions-électrons
- Méthode d'élimination de Gauss
- Jeu de mémoire
- Trouvez les paires
- Tableaux et articles
- Chimie
- Liste des abréviations et acronymes
- Systèmes cristallins et réseaux de Bravais
- SGH - Pictogrammes de danger
- NFPA 704 feu diamant
- Constantes physiques fondamentales
- Constantes du produit de solubilité
- SI - Système international d'unités
- Composition des melanges et des solutions
- Calcul stœchiométrique
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Écologie
- Web design
- Dictionnaire de chimie (anglais-croate)
- Chimie
- Télécharger
- ≡ Menu
