TITAN
UEBERGANGSELEMENTE: TITANGRUPPE
| Ordnungszahl: | 22 |
| Elementgruppen: | 4 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d2 4s2 |
| Oxidationszustände: | +2 +3 +4 |
| Elekronegativität: | 1.54 |
| Atomradius / pm: | 144.8 |
| Relative atommasse: | 47.867(1) |
Endeckung:1791 William Gregor (GB)
Das Element Titan wurde nach dem Titanen (Götter oder Riesen der griechischen Mythologie) benannt. Titan ist ein silberweiß glänzendes, gut dehn- und schmiedbares Leichtmetall, das sich durch hervorragende mechanische Festigkeit auszeichnet. Titan gehört zu den häufigsten Elementen der festen Erdkruste. Elementar kommt es jedoch in der Natur nie vor, sondern immer nur chemisch gebunden. Titan und seine Legierungen sind zur Herstellung von technischen Gegenständen, bei denen es auf geringes Gewicht und hohe mechanische Belastbarkeit ankommt, von großer Bedeutung. Daher finden sie im Flugzeugbau, in der Weltraumfahrt, im Schiffs- und U-Bootbau, in der Reaktortechnik, im Anlagenbau und im chemischen Apparatebau.
| Dichte / g dm-3: | 4540 | (293 K) |
| 4110 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 10.54 | (293 K) |
| 11.65 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 42 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 21.9 |
| Schmelzpunkt / °C: | 1668 |
| Siedepunkt / °C: | 3287 |
| Bildungsenergie / kJ mol-1: | 20.9 |
| Verdampfungsenergie / kJ mol-1: | 425.5 |
| Zerstäubungsenergie / kJ mol-1: | 467.14 |
| Erste ionisierungenergie / kJ mol-1: | 658.82 |
| Zweite ionisierungenergie / kJ mol-1: | 1309.85 |
| Dritte ionisierungenergie / kJ mol-1: | 2652.56 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 5400 |
| in den Ozeanen / ppm: | 0.001 |
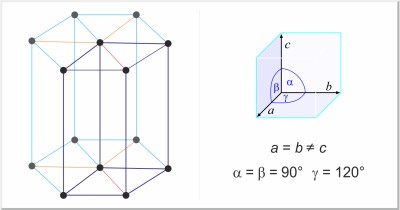
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=295.11, c=468.43 |
| Raumgruppe: | P63/mmc |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 46Ti | 45.952629(1) | 8.0(1) |
| 47Ti | 46.951764(1) | 7.3(1) |
| 48Ti | 47.947947(1) | 73.8(1) |
| 49Ti | 48.947871(1) | 5.5(1) |
| 50Ti | 49.944792(1) | 5.4(1) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| TiIV + e- → TiIII | - 0.092 | (1 mol dm-3 HCl) |
| TiIV + 4e- → Ti(s) | - 0.88 | (1 mol dm-3 HCl) |
| Ti3+ + e- → Ti2+ | - 0.369 | |
| Ti2+ + 2e- → Ti(s) | - 1.630 | |
| TiO22+ + H+ + 4e- → HTiO2- | +1.303 | |
| TiO22+ + 2H+ + 2e- → TiO2+ + H2O | +1.800 | |
| TiO2(s) + 4H+ + e- → Ti3+ + H2O | - 0.666 | |
| TiO2(s) + 4H+ + 2e- → Ti2+ + H2O | - 0.502 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.099 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.04 | (1 mol dm-3 H2SO4) |
| TiO2+ + 2H+ + 2e- → Ti2+ + H2O | - 0.135 | |
| HTiO2- + 5H+ + 2e- → Ti2+ + 3H2O | +0.362 | |
| TiF62- + 4e- → Ti(s) + 6F- | - 1.19 |
| 21 Scandium | ← | 22 Titan | → | 23 Vanadium |
Zitieren dieser Seite:
Generalic, Eni. "Titan." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/ti.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
