VODIK
| Atomski broj: | 1 |
| Skupina: | 1 |
| Perioda: | 1 |
| Elektronska konfiguracija: | 1s1 |
| Oksidacijski broj: | -1 +1 |
| Elektronegativnost: | 2.2 |
| Atomski radijus / pm: | 37.3 |
| Relativna atomska masa: | [1.007 84, 1.008 11] |
Vodik je 1766. godine otkrio Sir Henry Cavendish (GB). Ime mu je dao Lavoisie od grčkih riječi hydro što znači voda i genes što znači tvoriti. To je plin bez boje i mirisa, netopljiv u vodi. Lako difundira kroz sve materijale. Zapaljiv je i pravi eksplozivne smjese u zraku. Zapaljen na zraku gori svijetlim vrućim plamenom dajući vodenu paru. Na povišenoj temperaturi lako se spaja s kisikom, sumporom i halogenim elementima. Procjenjuje se da 90% svih atoma, odnosno skoro 3/4 mase svemira, otpada na vodik. Sve zvijezde, pa i Sunce, sastavljene su uglavnom od vodika (više od 90%). Vodik se u prirodi rijetko nalazi u elementarnom stanju, samo u višim slojevima atmosfere ili u vulkanskim plinovima. Uglavnom je vezan u spojevima od kojih su najrašireniji voda (H2O), amonijak (NH3) i razni organski spojevi. Čisti vodik se najčešće dobiva elektrolizom vode. Laboratorijski se dobiva reakcijom sulfatne kiseline i elementarnog cinka dok se industrijski dobiva prevođenjem vodene pare preko užarenog koksa. Upotrebljava se za sintezu amonijaka, hidriranje ugljena i ulja, proizvodnju kloridne kiseline i kao redukcijsko sredstvo. Cijena plinovitog vodika čistoće 99.999% iznosi 200.70 €/dm3 u malim pakovanjima (1 dm3) i oko 2.21 €/dm3 u velikom pakovanju (300 dm3).
| Gustoća / g dm-3: | 76.0 | (čvrsto stanje, 11 K) |
| 70.8 | (tekuće stanje, t.v.) | |
| 0.08988 | (plinovito stanje, 273 K) | |
| Molarni volumen / cm3mol-1: | 13.26 | (čvrsto stanje, 11 K) |
| 14.24 | (tekuće stanje, t.v.) | |
| 22423.54 | (plinovito stanje, 273 K) | |
| Električna otpornost / µΩcm: | - | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 0.183 |
| Temperatura taljenja / °C: | -259.34 |
| Temperatura vrenja / °C: | 252.87 |
| Toplina taljenja / kJ mol-1: | 0.12 |
| Toplina isparavanja / kJ mol-1: | 0.46 |
| Toplina atomiziranja / kJ mol-1: | 216.003 |
| Prva energija ionizacije / kJ mol-1: | 1312.06 |
| Druga energija ionizacije / kJ mol-1: | - |
| Treća energija ionizacije / kJ mol-1: | - |
| u atmosferi / ppm: | 0.53 |
| u Zemljinoj kori / ppm: | 1400 |
| u oceanima / ppm: | (H2O) |
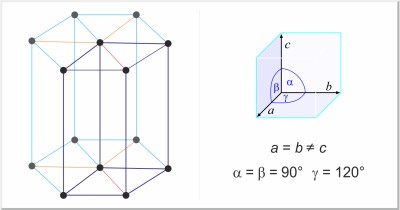
| Kristalna struktura: | heksagonska |
| Dimenzije jedinične ćelije / pm: | a=377.6, c=616.2 |
| Prostorna grupa: | P63/mmc |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 1H | 1.007825032(1) | 99.985(1) |
| 2H | 2.014101778(1) | 0.015(1) |
| 3H | 3.016049268(1) | * |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| 2H+ + 2e- → H2(g) | 0.000 | |
| 2H+ + 2e- → H2(g) | - 0.41 | ([H+] = 10-7 mol dm-3) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HCl) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HClO4) |
| 2H2O + 2e- → H2(g) + 2OH- | - 0.83 | |
| H2O2 + 2H+ + 2e- → 2H2O | +1.77 | |
| HO2- + H2O + 2e- → 3OH- | +0.88 | |
| H2(g) + 2e- → 2H- | - 2.25 |
Citiranje ove stranice:
Generalić, Eni. "Vodik." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. {Datum pristupa}. <https://www.periodni.com/hr/h.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
