TITANIJ
PRIJELAZNI ELEMENT: SKUPINA TITANIJA
| Atomski broj: | 22 |
| Skupina: | 4 |
| Perioda: | 4 |
| Elektronska konfiguracija: | [Ar] 3d2 4s2 |
| Oksidacijski broj: | +2 +3 +4 |
| Elektronegativnost: | 1.54 |
| Atomski radijus / pm: | 144.8 |
| Relativna atomska masa: | 47.867(1) |
Titanij je 1791. godine otkrio William Gregor (GB). Dobio ime prema Titanima sinovima Geje, božice zemlje iz grčke mitologije. To je srebrni, sjajni, tvrdi metal. Pri visokoj temperaturi gori na zraku. Prilikom zagrijavanja lako se spaja i s ugljikom, i s kisikom, i s dušikom. Izložena površina se presvuče oksidnim filmom. Ne reagira s lužinama niti s hladnim kiselinama, osim fluoridne. Vruće kiseline ga otapaju. Titanij je deveti element po rasprostranjenosti u zemljinoj kori ali se malo gdje nalazi koncentriran u većim količinama. Glavne titanijeve rude su ilmenit (FeTiO3) i rutil (TiO2). Ima malu gustoću a veliku tvrdoću i korozijsku otpornost, pa se upotrebljava u vojnoj industriji za proizvodnju supersoničnih aviona i za izradu specijalnih aparata za kemijsku industriju. Cijena spužvastog titana čistoće 99.95% iznosi 202.80 € za 1000 g.
| Gustoća / g dm-3: | 4540 | (293 K) |
| 4110 | (t.t.) | |
| Molarni volumen / cm3mol-1: | 10.54 | (293 K) |
| 11.65 | (t.t.) | |
| Električna otpornost / µΩcm: | 42 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 21.9 |
| Temperatura taljenja / °C: | 1668 |
| Temperatura vrenja / °C: | 3287 |
| Toplina taljenja / kJ mol-1: | 20.9 |
| Toplina isparavanja / kJ mol-1: | 425.5 |
| Toplina atomiziranja / kJ mol-1: | 467.14 |
| Prva energija ionizacije / kJ mol-1: | 658.82 |
| Druga energija ionizacije / kJ mol-1: | 1309.85 |
| Treća energija ionizacije / kJ mol-1: | 2652.56 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 5400 |
| u oceanima / ppm: | 0.001 |
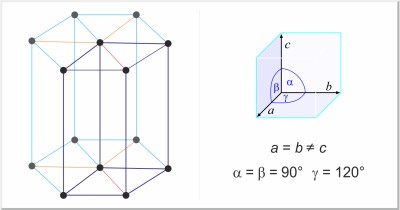
| Kristalna struktura: | heksagonska |
| Dimenzije jedinične ćelije / pm: | a=295.11, c=468.43 |
| Prostorna grupa: | P63/mmc |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 46Ti | 45.952629(1) | 8.0(1) |
| 47Ti | 46.951764(1) | 7.3(1) |
| 48Ti | 47.947947(1) | 73.8(1) |
| 49Ti | 48.947871(1) | 5.5(1) |
| 50Ti | 49.944792(1) | 5.4(1) |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| TiIV + e- → TiIII | - 0.092 | (1 mol dm-3 HCl) |
| TiIV + 4e- → Ti(s) | - 0.88 | (1 mol dm-3 HCl) |
| Ti3+ + e- → Ti2+ | - 0.369 | |
| Ti2+ + 2e- → Ti(s) | - 1.630 | |
| TiO22+ + H+ + 4e- → HTiO2- | +1.303 | |
| TiO22+ + 2H+ + 2e- → TiO2+ + H2O | +1.800 | |
| TiO2(s) + 4H+ + e- → Ti3+ + H2O | - 0.666 | |
| TiO2(s) + 4H+ + 2e- → Ti2+ + H2O | - 0.502 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.099 | |
| TiO2+ + 2H+ + e- → Ti3+ + H2O | +0.04 | (1 mol dm-3 H2SO4) |
| TiO2+ + 2H+ + 2e- → Ti2+ + H2O | - 0.135 | |
| HTiO2- + 5H+ + 2e- → Ti2+ + 3H2O | +0.362 | |
| TiF62- + 4e- → Ti(s) + 6F- | - 1.19 |
| 21 Skandij | ← | 22 Titanij | → | 23 Vanadij |
Citiranje ove stranice:
Generalić, Eni. "Titanij." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/hr/ti.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
