WASSERSTOFF
| Ordnungszahl: | 1 |
| Elementgruppen: | 1 |
| Perioden: | 1 |
| Elektronenkonfiguration: | 1s1 |
| Oxidationszustände: | -1 +1 |
| Elekronegativität: | 2.2 |
| Atomradius / pm: | 37.3 |
| Relative atommasse: | [1.007 84, 1.008 11] |
Endeckung:1766 Sir Henry Cavendish (GB)
Das Elementsymbol H leitet sich von der den französischen Namen hydrogène von griechisch hydor (Wasser) und gennáo (erzeugen). Die deutsche Bezeichnung lässt auf die gleiche Begriffsherkunft schließen. Wasserstoff ist bei Zimmertemperatur ein farbloses, geruchloses und geschmackloses Gas. Es ist das chemische Element mit der geringsten Dichte � weniger als 10% der von Luft. Gemische mit Sauerstoff oder mit Chlor explodieren bei Zündung sehr heftig. Wasserstoff wird im Labor durch Einwirkung verdünnter Säuren auf Metalle (wie Zink) oder durch Elektrolyse von Wasser hergestellt. Wasserstoff wird zur Herstellung von Ammoniak und Methanol, zur Hydrierung von Fetten und Ölen, Stromerzeugung in Brennstoffzellen und als Raketentreibstoff.
| Dichte / g dm-3: | 76.0 | (fest, 11 K) |
| 70.8 | (flüssig, b.p.) | |
| 0.08988 | (gasförmig, 273 K) | |
| Atomvolumen / cm3mol-1: | 13.26 | (fest, 11 K) |
| 14.24 | (flüssig, b.p.) | |
| 22423.54 | (gasförmig, 273 K) | |
| Elektrische widerstandskraft / µΩcm: | - | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.183 |
| Schmelzpunkt / °C: | -259.34 |
| Siedepunkt / °C: | 252.87 |
| Bildungsenergie / kJ mol-1: | 0.12 |
| Verdampfungsenergie / kJ mol-1: | 0.46 |
| Zerstäubungsenergie / kJ mol-1: | 216.003 |
| Erste ionisierungenergie / kJ mol-1: | 1312.06 |
| Zweite ionisierungenergie / kJ mol-1: | - |
| Dritte ionisierungenergie / kJ mol-1: | - |
| in der Atmosphäre / ppm: | 0.53 |
| in der Erdkruste / ppm: | 1400 |
| in den Ozeanen / ppm: | (H2O) |
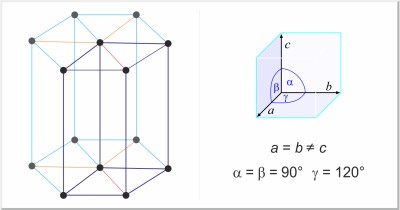
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=377.6, c=616.2 |
| Raumgruppe: | P63/mmc |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 1H | 1.007825032(1) | 99.985(1) |
| 2H | 2.014101778(1) | 0.015(1) |
| 3H | 3.016049268(1) | * |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| 2H+ + 2e- → H2(g) | 0.000 | |
| 2H+ + 2e- → H2(g) | - 0.41 | ([H+] = 10-7 mol dm-3) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HCl) |
| 2H+ + 2e- → H2(g) | - 0.005 | (1 mol dm-3 HClO4) |
| 2H2O + 2e- → H2(g) + 2OH- | - 0.83 | |
| H2O2 + 2H+ + 2e- → 2H2O | +1.77 | |
| HO2- + H2O + 2e- → 3OH- | +0.88 | |
| H2(g) + 2e- → 2H- | - 2.25 |
Zitieren dieser Seite:
Generalic, Eni. "Wasserstoff." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/h.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
