QUECKSILBER
UEBERGANGSELEMENTE: ZINKGRUPPE
| Ordnungszahl: | 80 |
| Elementgruppen: | 12 |
| Perioden: | 6 |
| Elektronenkonfiguration: | [Xe] 4f14 5d10 6s2 |
| Oxidationszustände: | +1 +2 |
| Elekronegativität: | 1.9 |
| Atomradius / pm: | 150.3 |
| Relative atommasse: | 200.592(3) |
Endeckung:- -
Das Symbol Hg stammt von dem griechischen 'hydrargyrum' (Wassersilber). Der deutsche Name stammt vom 'quecsilabar' (lebendiges Silber). Quecksilber ist ein silberweiß glänzendes, bei Zimmertemperatur flüssiges Schwermetall. Mit zahlreichen Metallen bildet Quecksilber sehr leicht Legierungen, die Amalgame. Die Herstellung erfolgt durch das Erhitzen von Zinnobererz in Öfen unter Luftstrom bei Temperaturen über 400°C. Elementares Quecksilber wird zur Herstellung von Thermometern, Barometern, Blutdruckmessern, für Quecksilberdampflampen und Batterien, als Kathodenmaterial bei der Chloralkalielektrolyse.
| Dichte / g dm-3: | 13546 | (293 K) |
| Atomvolumen / cm3mol-1: | 14.81 | (293 K) |
| Elektrische widerstandskraft / µΩcm: | 95.8 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 8.34 |
| Schmelzpunkt / °C: | -38.83 |
| Siedepunkt / °C: | 356.73 |
| Bildungsenergie / kJ mol-1: | 2.331 |
| Verdampfungsenergie / kJ mol-1: | 59.11 |
| Zerstäubungsenergie / kJ mol-1: | 64.463 |
| Erste ionisierungenergie / kJ mol-1: | 1007.07 |
| Zweite ionisierungenergie / kJ mol-1: | 1809.69 |
| Dritte ionisierungenergie / kJ mol-1: | 3299.82 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.08 |
| in den Ozeanen / ppm: | 0.00003 |
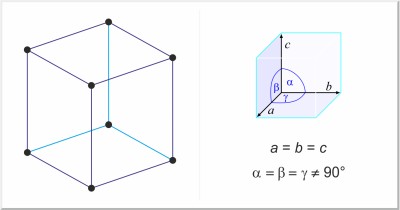
| Kristallstruktur: | rhomboedrisch |
| Gitterparameter der Elementarzelle / pm: | a=299.25, α=70°44.6' |
| Raumgruppe: | R3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 196Hg | 195.965815(4) | 0.15(1) |
| 198Hg | 197.966752(3) | 9.97(8) |
| 199Hg | 198.968262(3) | 16.87(10) |
| 200Hg | 199.968309(3) | 23.10(16) |
| 201Hg | 200.970285(3) | 13.18(8) |
| 202Hg | 201.970626(3) | 29.86(20) |
| 204Hg | 203.973476(3) | 6.87(4) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Hg2+ + 2e- → Hg(l) | +0.854 | |
| 2Hg2+ + 2e- → Hg22+ | +0.920 | |
| 2Hg2+ + 2e- → Hg22+ | +0.907 | (1 mol dm-3 HClO4) |
| Hg22+ + 2e- → 2Hg(l) | +0.788 | |
| Hg22+ + 2e- → 2Hg(l) | +0.274 | (1 mol dm-3 HCl) |
| Hg22+ + 2e- → 2Hg(l) | +0.776 | (1 mol dm-3 HClO4) |
| Hg22+ + 2e- → 2Hg(l) | +0.674 | (1 mol dm-3 H2SO4) |
| HgO(s) + H2O + 2e- → Hg(l) + 2OH- | +0.10 | |
| HgO(s) + 2H+ + 2e- → Hg(l) + H2O | +0.93 | |
| 2Hg(OH)2(s) + 4H+ + 2e- → Hg22+ + 4H2O | +1.28 | |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.268 | |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.244 | (saturated KCl) |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.282 | (1 mol dm-3 KCl) |
| Hg2Cl2(s) + 2e- → 2Hg(l) + 2Cl- | +0.334 | (0.1 mol dm-3 KCl) |
| Hg2Br2(s) + 2e- → 2Hg(l) + 2Br- | +0.14 | |
| Hg2I2(s) + 2e- → 2Hg(l) + 2I- | - 0.04 | |
| Hg2C2O4(s) + 2e- → 2Hg(l) + C2O42- | +0.42 | |
| Hg2SO4(s) + 2e- → 2Hg(l) + SO42- | +0.615 | |
| HgS(s) (schwarz) + 2e- → Hg(l) + S2- | - 0.67 | |
| HgS(s) (rot) + 2e- → Hg + S2- | - 0.70 | |
| Hg(CN)42- + 2e- → Hg(l) + 4CN- | - 0.37 |
| 79 Gold | ← | 80 Quecksilber | → | 81 Thallium |
Zitieren dieser Seite:
Generalic, Eni. "Quecksilber." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 29 Mar. 2025. <https://www.periodni.com/de/hg.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
