I
Iodum
IOD
HALOGENE ELEMENT
| Ordnungszahl: | 53 |
| Elementgruppen: | 17 |
| Perioden: | 5 |
| Elektronenkonfiguration: | [Kr] 4d10 5s2 5p5 |
| Oxidationszustände: | -1 +1 +5 +7 |
| Elekronegativität: | 2.66 |
| Atomradius / pm: | 133.1 |
| Relative atommasse: | 126.904 47(3) |
Endeckung:1811 Bernard Courtois (FR)
Der Name Iod stammt von dem griechischem Wort ioeides (veilchenfarben). Es bildet schwarzgraue, metallisch glänzende Blättchen, die schon bei Raumtemperatur zu gasförmigem Iod sublimieren. Verbindungen des Jods finden sich in geringen Mengen überall in der Natur, besonders in Meerwasser, Meeresalgen, Mineralwasser. Elementares Iod und seine Verbindungen dienen zur Herstellung von Desinfektionsmitteln, und als Spurenelementzusatz für Nahrung aufgenommen.
| Dichte / g dm-3: | 4930 | (293 K) |
| Atomvolumen / cm3mol-1: | 25.74 | (293 K) |
| Elektrische widerstandskraft / µΩcm: | 1.3E+15 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.449 |
| Schmelzpunkt / °C: | 113.7 |
| Siedepunkt / °C: | 184.4 |
| Bildungsenergie / kJ mol-1: | 15.27 |
| Verdampfungsenergie / kJ mol-1: | 41.67 |
| Zerstäubungsenergie / kJ mol-1: | 107.24 |
| Erste ionisierungenergie / kJ mol-1: | 1008.40 |
| Zweite ionisierungenergie / kJ mol-1: | 1845.90 |
| Dritte ionisierungenergie / kJ mol-1: | 3184.04 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.5 |
| in den Ozeanen / ppm: | 0.05 |
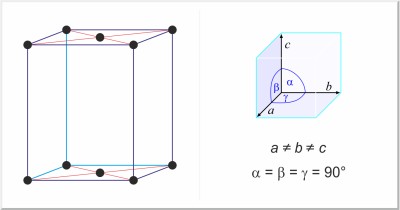
| Kristallstruktur: | orthorhombisch-basiszentriert |
| Gitterparameter der Elementarzelle / pm: | a=726.47, b=478.57, c=979.08 |
| Raumgruppe: | Cmca |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 127I | 126.904468(4) | 100 |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| I2(s) + 2e- → 2I- | +0.535 | |
| I2(aq) + 2e- → 2I- | +0.615 | |
| 3I2 + 2e- → 2I3- | +0.789 | |
| I3- + 2e- → 3I- | +0.536 | |
| H5IO6 + H+ + 2e- → IO3- + 3H2O | +1.601 | |
| HIO52- + 3H+ + 2e- → IO3- + 2H2O | +1.898 | |
| HIO52- + 8H+ + 6e- → HIO + 4H2O | +1.389 | |
| 2HIO52- + 18H+ + 14e- → I2(s) + 10H2O | +1.384 | |
| 3HIO52- + 27H+ + 22e- → I3- + 15H2O | +1.357 | |
| HIO52- + 9H+ + 8e- → I- + 5H2O | +1.288 | |
| HIO4 + 2H+ + 2e- → HIO3 + H2O | +1.626 | |
| IO4- + 2H+ + 2e- → IO3- + H2O | +1.653 | |
| HIO4 + 6H+ + 6e- → HIO + 3H2O | +1.290 | |
| IO4- + 7H+ + 6e- → HIO + 3H2O | +1.235 | |
| 2HIO4 + 14H+ + 14e- → I2(s) + 8H2O | +1.300 | |
| 3HIO4 + 21H+ + 22e- → I3- + 12H2O | +1.276 | |
| HIO4 + 7H+ + 8e- → I- + 4H2O | +1.215 | |
| IO3- + 6H+ + 4e- → I+ + 3H2O | +1.155 | |
| IO3- + 4H+ + 4e- → IO- + 2H2O | +0.972 | |
| 2IO3- + 12H+ + 10e- → I2(s) + 6H2O | +1.196 | |
| 2IO3- + 12H+ + 10e- → I2(aq) + 6H2O | +1.178 | |
| IO3- + 2Cl- + 6H+ + 4e- → ICl2- + 3H2O | +1.24 | |
| 2HIO3 + 10H+ + 10e- → I2(s) + 6H2O | +1.169 | |
| 3HIO3 + 15H+ + 16e- → I3- + 9H2O | +1.145 | |
| HIO3 + 5H+ + 6e- → I- + 3H2O | +1.078 | |
| 2HIO + 2H+ + 2e- → I2(s) + 2H2O | +1.354 | |
| 2IO- + 4H+ + 2e- → I2(s) + 2H2O | +2.005 | |
| 3HIO + 3H+ + 4e- → I3- + 3H2O | +1.213 | |
| 3IO- + 6H+ + 4e- → I3- + 3H2O | +1.701 | |
| IO- + 2H+ + 2e- → I- + H2O | +1.313 | |
| HIO + H+ + 2e- → I- + H2O | +0.987 | |
| 2ICl3(s) + 6e- → I2(s) + 6Cl- | +1.28 | |
| 2ICl(s) + 2e- → I2(s) + 2Cl- | +1.22 | |
| 2ICl + 2e- → I2(s) + 2Cl- | +1.19 | |
| 2ICl2- + 2e- → I2(s) + 4Cl- | +1.056 | |
| 2IBr(aq) + 2e- → I2(s) + 2Br- | +1.02 |
Zitieren dieser Seite:
Generalic, Eni. "Iod." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 9 Apr. 2025. <https://www.periodni.com/de/i.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
Copyright © 1998-2025 by Eni Generalic. Alle Rechte vorbehalten. | Bibliographie | Disclaimer
