SELEN
CHALKOGENE ELEMENT
| Ordnungszahl: | 34 |
| Elementgruppen: | 16 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d10 4s2 4p4 |
| Oxidationszustände: | -2 +4 +6 |
| Elekronegativität: | 2.55 |
| Atomradius / pm: | 116 |
| Relative atommasse: | 78.971(8) |
Endeckung:1817 Jöns Jacob Berzelius (SE)
Der Name Selen stammt nach der griechischen Mondgöttin Selene. Selen zeigt ähnlich wie der Schwefel eine große Vielfalt an Erscheinungsformen. Das graue, metallische Selen ist die bei Raumtemperatur stabilste Modifikation. Selen ist ein seltenes Element. Als Element kommt es in der Natur sehr selten gediegen vor, meist in Verbindung mit Schwefel. Die technische Gewinnung erfolgt aus dem Anodenschlamm bei der Kupferraffination. Selen ist ein wichtiger Rohstoff für die Halbleiterindustrie und dient zur Herstellung von Photozellen, Solarzellen, Belichtungsmessern, Radaranlagen oder von fotoleitenden Schichten bei Fotokopiergeräten.
| Dichte / g dm-3: | 4790 | (grau, 293 K) |
| 3987 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 16.48 | (grau, 293 K) |
| 19.80 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 12 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 2.04 |
| Schmelzpunkt / °C: | 221 |
| Siedepunkt / °C: | 685 |
| Bildungsenergie / kJ mol-1: | 5.1 |
| Verdampfungsenergie / kJ mol-1: | 90 |
| Zerstäubungsenergie / kJ mol-1: | 226.4 |
| Erste ionisierungenergie / kJ mol-1: | 940.97 |
| Zweite ionisierungenergie / kJ mol-1: | 2044.54 |
| Dritte ionisierungenergie / kJ mol-1: | 2973.74 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.05 |
| in den Ozeanen / ppm: | - |
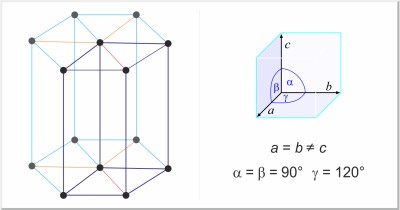
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=436.56, c=495.90 |
| Raumgruppe: | P3121 |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 74Se | 73.922477(2) | 0.89(2) |
| 76Se | 75.919214(2) | 9.36(11) |
| 77Se | 76.919915(2) | 7.63(6) |
| 78Se | 77.917310(2) | 23.78(9) |
| 80Se | 79.916522(2) | 49.61(10) |
| 82Se | 81.916700(2) | 8.73(6) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| SeO42- + 2H+ + 2e- → SeO32- + H2O | +0.880 | |
| SeO42- + H2O + 2e- → SeO32- + 2OH- | +0.05 | |
| SeO42- + 3H+ + 2e- → HSeO3- + H2O | +1.075 | |
| SeO42- + 4H+ + 2e- → H2SeO3 + H2O | +1.15 | |
| HSeO4- + 3H+ + 2e- → H2SeO3 + H2O | +1.090 | |
| SeO32- + 6H+ + 4e- → Se(s) + 3H2O | +0.875 | |
| HSeO3- + 5H+ + 4e- → Se(s) + 3H2O | +0.778 | |
| H2SeO3 + 4H+ + 4e- → Se(s) + 3H2O | +0.740 | |
| SeO32- + 6H+ + 6e- → Se2- + 3H2O | +0.276 | |
| SeO32- + 7H+ + 6e- → HSe- + 3H2O | +0.414 | |
| HSeO3- + 6H+ + 6e- → HSe- + 3H2O | +0.349 | |
| HSeO3- + 7H+ + 6e- → H2Se(g) + 3H2O | +0.386 | |
| H2SeO3 + 6H+ + 6e- → H2Se(g) + 3H2O | +0.360 | |
| Se(s) + 2H+ + 2e- → H2Se(g) | - 0.369 | |
| Se(s) + 2e- → Se2- | - 0.924 | |
| Se(s) + H+ + 2e- → HSe- | - 0.510 | |
| Se(s) + 2H+ + 2e- → H2Se(g) | - 0.399 |
Zitieren dieser Seite:
Generalic, Eni. "Selen." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/se.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
