CHLOR
HALOGENE ELEMENT
| Ordnungszahl: | 17 |
| Elementgruppen: | 17 |
| Perioden: | 3 |
| Elektronenkonfiguration: | [Ne] 3s2 3p5 |
| Oxidationszustände: | -1 +1 +5 +7 |
| Elekronegativität: | 3.16 |
| Atomradius / pm: | 99.4 |
| Relative atommasse: | [35.446, 35.457] |
Endeckung:1774 Carl William Scheele (SE)
Der Name Chlor leitet sich vom griechisch chlorós (gelblich grün), wegen der Farbe von Chlorgas. Es ist ein stark stechend riechendes, gelbgrünes Gas. Wegen seiner großen Reaktionsfähigkeit kommt es im elementaren Zustand jedoch in der Natur außer in einigen Vulkangasen praktisch nicht vor. Im Labor lässt sich Chlor durch das Zusammenwirken von konzentrierter Salzsäure und einem Oxidationsmittel wie Braunstein oder Kaliumpermanganat herstellen. Chlor ist ein wichtiges Zwischenprodukt zur Herstellung zahlreicher anorganischer und organischer Verbindungen. Ferner dient Chlorgas in Schwimmbädern und im Trinkwasser zur Desinfektion.
| Dichte / g dm-3: | 2030 | (113 K) |
| 1507 | (239 K) | |
| 3.214 | (273 K) | |
| Atomvolumen / cm3mol-1: | 17.46 | (113 K) |
| 23.53 | (239 K) | |
| 22061.61 | (273 K) | |
| Elektrische widerstandskraft / µΩcm: | - | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.0089 |
| Schmelzpunkt / °C: | -101.5 |
| Siedepunkt / °C: | -34.04 |
| Bildungsenergie / kJ mol-1: | 6.41 |
| Verdampfungsenergie / kJ mol-1: | 20.4033 |
| Zerstäubungsenergie / kJ mol-1: | 120 |
| Erste ionisierungenergie / kJ mol-1: | 1251.20 |
| Zweite ionisierungenergie / kJ mol-1: | 2297.72 |
| Dritte ionisierungenergie / kJ mol-1: | 3821.81 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 130 |
| in den Ozeanen / ppm: | 19000 |
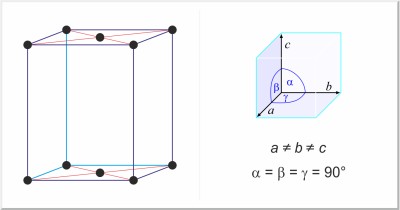
| Kristallstruktur: | orthorhombisch-basiszentriert |
| Gitterparameter der Elementarzelle / pm: | a=624, b=448, c=826 |
| Raumgruppe: | Cmca |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 35Cl | 34.96885271(4) | 75.77(7) |
| 37Cl | 36.96590260(5) | 24.23(7) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Cl2(g) + 2e- → 2Cl- | +1.359 | |
| Cl2(aq) + 2e- → 2Cl- | +1.39 | |
| ClO4- + 2H+ + 2e- → ClO3- + H2O | +1.19 | |
| ClO4- + H2O + 2e- → ClO3- + 2OH- | +0.36 | |
| 2ClO4- + 16H+ + 14e- → Cl2(g) + 8H2O | +1.39 | |
| ClO3- + 3H+ + 2e- → HClO2 + H2O | +1.21 | |
| ClO3- + H2O + 2e- → ClO2- + 2OH- | +0.33 | |
| 2ClO3- + 12H+ + 10e- → Cl2(g) + 3H2O | +1.47 | |
| HClO2 + 2H+ + 2e- → HClO + H2O | +1.64 | |
| ClO2- + H2O + 2e- → ClO- + 2OH- | +0.66 | |
| 2HClO + 2H+ + 2e- → Cl2(g) + H2O | +1.63 | |
| 2ClO- + 2H2O + 2e- → Cl2(g) + 4OH- | +0.40 |
| 16 Schwefel | ← | 17 Chlor | → | 18 Argon |
Zitieren dieser Seite:
Generalic, Eni. "Chlor." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. {Datum des Abrufs}. <https://www.periodni.com/de/cl.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
