SAUERSTOFF
CHALKOGENE ELEMENT
| Ordnungszahl: | 8 |
| Elementgruppen: | 16 |
| Perioden: | 2 |
| Elektronenkonfiguration: | [He] 2s2 2p4 |
| Oxidationszustände: | -2 |
| Elekronegativität: | 3.44 |
| Atomradius / pm: | 60.4 |
| Relative atommasse: | [15.999 03, 15.999 77] |
Endeckung:1772 Carl William Scheele (SE)
Das Elementsymbol O leitet sich von der den französischen Namen oxygène von griechisch oxus (sauer) und gennáo (erzeugen). Sauerstoff ist bei Zimmertemperatur ein farb- und geruchloses Gas, welches schwerer als Luft ist. Sauerstoff tritt normalerweise als zweiatomiges Molekül auf (O2), daneben ist unter natürlichen Bedingungen auch eine dreiatomige Form, das Ozon, stabil. Er ist in der Luft zu 20,95 Volumenprozent (etwa 23,15 Gewichtsprozent) als freier Sauerstoff enthalten. Viele Mineralien in der Erdkruste wie Eisenoxid oder Kalkstein enthalten Sauerstoffatome. Im Labor erhält man Sauerstoff (neben Wasserstoff) durch die elektrolytische Zersetzung von Wasser. In der Technik wird Sauerstoff überall dort verwendet, wo Verbrennungsvorgänge unter hohen Temperaturen durchgeführt werden sollen: beim Schweißen, im Hochofen, bei der Stahlerzeugung nach dem Sauerstoffblasverfahren, als Raketentreibstoff.
| Dichte / g dm-3: | 2000 | (fest, m.p.) |
| 1140 | (b.p.) | |
| 1.429 | (gasförmig, 273 K) | |
| Atomvolumen / cm3mol-1: | 8.00 | (fest, m.p.) |
| 14.03 | (b.p.) | |
| 22392.44 | (gasförmig, 273 K) | |
| Elektrische widerstandskraft / µΩcm: | - | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.0263 |
| Schmelzpunkt / °C: | -218.7916 |
| Siedepunkt / °C: | -182.95 |
| Bildungsenergie / kJ mol-1: | 0.444 |
| Verdampfungsenergie / kJ mol-1: | 6.82 |
| Zerstäubungsenergie / kJ mol-1: | 246.785 |
| Erste ionisierungenergie / kJ mol-1: | 1313.95 |
| Zweite ionisierungenergie / kJ mol-1: | 3388.33 |
| Dritte ionisierungenergie / kJ mol-1: | 5300.51 |
| in der Atmosphäre / ppm: | 209500 |
| in der Erdkruste / ppm: | 466000 |
| in den Ozeanen / ppm: | (H2O) |
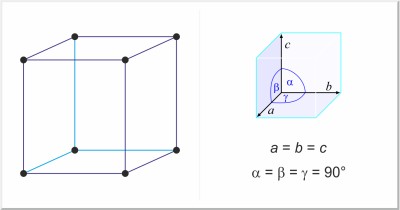
| Kristallstruktur: | kubisch-primitiv |
| Gitterparameter der Elementarzelle / pm: | a=683 |
| Raumgruppe: | Pm3n |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 16O | 15.994914622(2) | 99.762(15) |
| 17O | 16.9991315(2) | 0.038(3) |
| 18O | 17.9991604(9) | 0.200(12) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| O2(g) + 4H+ + 4e- → 2H2O | +1.229 | |
| O2(g) + 4H+ + 4e- → 2H2O | +0.815 | ([H+] = 10-7 mol dm-3) |
| O2(g) + 2H2O + 4e- → 4OH- | +0.401 | |
| O2(g) + H2O + 2e- → HO2- + OH- | +0.076 | |
| O2(g) + 2H+ + 2e- → H2O2 | +0.682 | |
| O3(g) + 2H+ + 2e- → O2(g) + H2O | +2.07 | |
| O3(g) + 6H+ + 6e- → 3H2O | +1.501 | |
| O3(g) + H2O + 2e- → O2(g) + 2OH- | +1.24 | |
| HO2- + H2O + 2e- → 3OH- | +0.88 | |
| H2O2 + 2H+ + 2e- → 2H2O | +1.776 |
| 7 Stickstoff | ← | 8 Sauerstoff | → | 9 Fluor |
Zitieren dieser Seite:
Generalic, Eni. "Sauerstoff." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/o.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
