STICKSTOFF
STICKSTOFFGRUPPE
| Ordnungszahl: | 7 |
| Elementgruppen: | 15 |
| Perioden: | 2 |
| Elektronenkonfiguration: | [He] 2s2 2p3 |
| Oxidationszustände: | -3 -2 -1 +1 +2 +3 +4 +5 |
| Elekronegativität: | 3.04 |
| Atomradius / pm: | 54.9 |
| Relative atommasse: | [14.006 43, 14.007 28] |
Endeckung:1772 Daniel Rutherford (GB)
Das Elementsymbol N leitet sich von der lateinischen Bezeichnung nitrogenium für Salpeter (von griech. nitron) ab. Die deutsche Bezeichnung Stickstoff erinnert daran, dass Stickstoff Flammen 'erstickt'. Stickstoff ist bei Zimmertemperatur ein farb- und geruchloses Gas, welches eine geringfügig kleinere Dichte als Luft besitzt. Mit einem Anteil von 78.09 Volumenprozent ist er das weitaus häufigste Element der Erdatmosphäre. In der Technik erfolgt die Gewinnung durch Verflüssigung von Luft (Komprimieren und Abkühlen auf weniger als -200°C) und einer anschließenden fraktionierten Destillation. Stickstoff ist neben Wasserstoff ein wichtiger Ausgangstoff zur Synthese von Ammoniak nach dem Haber-Bosch-Verfahren und wird zur Herstellung zahlreicher Stickstoffverbindungen benötigt (z.b. Düngemittel oder Salpetersäure, Amine, Nitride).
| Dichte / g dm-3: | 1026 | (21 K) |
| 880 | (m.p.) | |
| 1.2506 | (gasförmig, 273 K) | |
| Atomvolumen / cm3mol-1: | 13.65 | (21 K) |
| 15.92 | (m.p.) | |
| 22399.97 | (gasförmig, 273 K) | |
| Elektrische widerstandskraft / µΩcm: | - | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 0.0258 |
| Schmelzpunkt / °C: | -210.00 |
| Siedepunkt / °C: | -195.8 |
| Bildungsenergie / kJ mol-1: | 0.72 |
| Verdampfungsenergie / kJ mol-1: | 5.577 |
| Zerstäubungsenergie / kJ mol-1: | 470.842 |
| Erste ionisierungenergie / kJ mol-1: | 1402.34 |
| Zweite ionisierungenergie / kJ mol-1: | 2856.11 |
| Dritte ionisierungenergie / kJ mol-1: | 4578.19 |
| in der Atmosphäre / ppm: | 780900 |
| in der Erdkruste / ppm: | 20 |
| in den Ozeanen / ppm: | 0.8 |
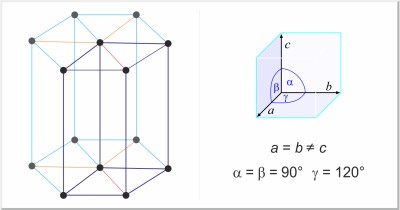
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=404.2, c=660.1 |
| Raumgruppe: | P63/mmc |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 14N | 14.003074005(1) | 99.634(9) |
| 15N | 15.000108898(1) | 0.366(9) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| N2(g) + 6H+ + 6e- → 2NH3(g) | +0.057 | |
| N2(g) + 2H2O + 6H+ + 6e- → 2NH�H2O | +0.092 | |
| N2(g) + 8H+ + 6e- → 2NH4+ | +0.275 | |
| N2(g) + 5H+ + 4e- → N2H5+ | - 0.23 | |
| NO3- + 2H+ + e- → NO2(g) + H2O | +0.775 | |
| 2NO3- + 4H+ + 2e- → N2O4(g) + 2H2O | +0.80 | |
| NO3- + 3H+ + 2e- → HNO2 + H2O | +0.94 | |
| NO3- + 3H+ + 2e- → HNO2 + H2O | +0.92 | (1 mol dm-3 HNO3) |
| NO3- + 2H+ + 2e- → NO2- + H2O | +0.835 | |
| NO3- + 4H+ + 3e- → NO(g) + H2O | +0.96 | |
| NO2(g) + e- → NO2- | +0.893 | |
| NO2(g) + H+ + e- → HNO2 | +1.093 | |
| NO2(g) + 2H+ + 2e- → NO(g) + H2O | +1.049 | |
| 2NO2(g) + 6H+ + 6e- → N2O(g) + 3H2O | +1.229 | |
| 2NO2(g) + 8H+ + 8e- → N2(g) + 4H2O | +1.363 | |
| NO2- + 2H+ + e- → NO(g) + H2O | +1.202 | |
| HNO2 + H+ + e- → NO(g) + H2O | +1.00 | |
| 2NO2- + 6H+ + 4e- → N2O(g) + 3H2O | +1.396 | |
| 2HNO2 + 4H+ + 4e- → N2O(g) + 3H2O | +1.297 | |
| 2NO2- + 8H+ + 6e- → N2(g) + 4H2O | +1.520 | |
| 2HNO2 + 6H+ + 6e- → N2(g) + 4H2O | +1.454 | |
| NO2- + 7H+ + 6e- → NH3(g) + 2H2O | +0.789 | |
| NO2- + 7H+ + 6e- → NH�H2O + H2O | +0.806 | |
| HNO2 + 7H+ + 6e- → NH4+ + 2H2O | +0.864 | |
| 2NO(g) + 2H+ + 2e- → N2O(g) + H2O | +1.591 | |
| 2NO(g) + 4H+ + 4e- → N2(g) + 2H2O | +1.678 | |
| NO(g) + 5H+ + 5e- → NH�H2O | +0.727 | |
| NO(g) + 6H+ + 5e- → NH4+ + H2O | +0.836 | |
| N2O(g) + 2H+ + 2e- → N2(g) + H2O | +1.766 | |
| N2O(g) + H2O + 8H+ + 8e- → 2NH�H2O | +0.510 | |
| N2O(g) + 10H+ + 8e- → 2NH4+ + H2O | +0.647 | |
| N3- + 7H2O + 6e- → N2H4 + NH3(g) + 7OH- | - 0.62 |
| 6 Kohlenstoff | ← | 7 Stickstoff | → | 8 Sauerstoff |
Zitieren dieser Seite:
Generalic, Eni. "Stickstoff." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/n.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
