SILICIUM
KOHLENSTOFFGRUPPE
| Ordnungszahl: | 14 |
| Elementgruppen: | 14 |
| Perioden: | 3 |
| Elektronenkonfiguration: | [Ne] 3s2 3p2 |
| Oxidationszustände: | -4 +2 +4 |
| Elekronegativität: | 1.9 |
| Atomradius / pm: | 117.6 |
| Relative atommasse: | [28.084, 28.086] |
Endeckung:1824 Jöns Jacob Berzelius (SE)
Der Begriff Silicium leitet sich vom lateinischen Wort silex (Kieselstein, Feuerstein) ab. Reines Silicium bildet dunkelgraue, glänzende, harte und spröde Kristalle mit Diamantstruktur. Reinstsilicium ist ein elektrischer Halbleiter, dessen Leitfähigkeit durch geringe Zusätze von Elementen der dritten oder fünften Hauptgruppe stark erhöht wird. In der Natur kommen Siliciumatome jedoch nie elementar vor, sondern immer gebunden in anorganischen Mineralien. Technisch wird Silicium durch Reduktion von Quarz, SiO2, mit Kohle im Lichtbogenofen bei Temperaturen um 2 000 °C erzeugt. Die gewonnenen Silicium-Einkristalle werden in dünne Scheiben zersägt. Sie stellen das wichtigste Rohmaterial zur Herstellung von Mikrochips und Halbleitern dar.
| Dichte / g dm-3: | 2329 | (293 K) |
| 2525 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 12.06 | (293 K) |
| 11.12 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 10 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 148 |
| Schmelzpunkt / °C: | 1414 |
| Siedepunkt / °C: | 3265 |
| Bildungsenergie / kJ mol-1: | 39.6 |
| Verdampfungsenergie / kJ mol-1: | 383.3 |
| Zerstäubungsenergie / kJ mol-1: | 451.29 |
| Erste ionisierungenergie / kJ mol-1: | 786.52 |
| Zweite ionisierungenergie / kJ mol-1: | 1577.15 |
| Dritte ionisierungenergie / kJ mol-1: | 3231.61 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 267700 |
| in den Ozeanen / ppm: | 3 |
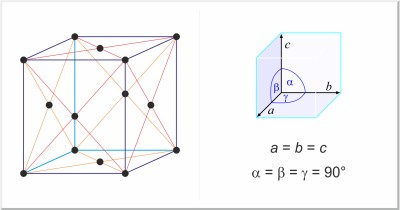
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=543.07 |
| Raumgruppe: | Fd3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 28Si | 27.976926533(2) | 92.23(1) |
| 29Si | 28.97649472(3) | 4.67(1) |
| 30Si | 29.97377022(5) | 3.10(1) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| SiO2(s) + 4H+ + 4e- → Si(s) + 2H2O | - 0.86 | |
| SiO32- + 6H+ + 4e- → Si(s) + 3H2O | - 0.455 | |
| HSiO3- + 5H+ + 4e- → Si(s) + 3H2O | - 0.632 | |
| H2SiO3 + 4H+ + 4e- → Si(s) + 3H2O | - 0.780 | |
| SiO2(s) + 8H+ + 8e- → SiH4(g) + 2H2O | - 0.377 | |
| SiO32- + 10H+ + 8e- → SiH4(g) + 3H2O | - 0.176 | |
| HSiO3- + 9H+ + 8e- → SiH4(g) + 3H2O | - 0.265 | |
| H2SiO3 + 8H+ + 8e- → SiH4(g) + 3H2O | - 0.339 | |
| Si(s) + 4H+ + 4e- → SiH4(g) | +0.102 | |
| SiF62- + 4e- → Si(s) + 6F- | - 1.2 |
| 13 Aluminium | ← | 14 Silicium | → | 15 Phosphor |
Zitieren dieser Seite:
Generalic, Eni. "Silicium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/si.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
