ALUMINIUM
BORGRUPPE
| Ordnungszahl: | 13 |
| Elementgruppen: | 13 |
| Perioden: | 3 |
| Elektronenkonfiguration: | [Ne] 3s2 3p1 |
| Oxidationszustände: | +3 |
| Elekronegativität: | 1.61 |
| Atomradius / pm: | 143.2 |
| Relative atommasse: | 26.981 5385(7) |
Endeckung:1825 Hans Christian Ørsted (DK)
Aluminium hat seinen Namen vom lateinischen Wort alumen (Alaun). Es ist ein silberweißes, relativ weiches Leichtmetall, das sehr gut dehnbar und verformbar ist. Es ist gegen Sauerstoff und Feuchtigkeit unempfindlich, da es nach anfänglicher Oxidation eine dünne dichte Oxidschicht bildet, die vor weiterem Angriff schützt (Passivierung). Das wichtigste Aluminiumerz ist der Bauxit, der im wesentlichen aus einem Gemisch von Al-Hydroxiden und Al-Oxiden besteht. Im Jahr 1898 wurde das Bayer-Verfahren entwickelt, mit dem die großtechnische Herstellung von Aluminiumpulver aus Bauxit möglich wurde. Aluminium und seine Legierungen gehören heute zu den wichtigsten Werkstoffen zum Bau von Profilen, Rohren und Blechen. In der Lebensmittelindustrie ist Aluminiumfolie ein wichtiges Verpackungsmittel.
| Dichte / g dm-3: | 2698 | (293 K) |
| 2390 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 10.00 | (293 K) |
| 11.29 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 2.65 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 237 |
| Schmelzpunkt / °C: | 660.32 |
| Siedepunkt / °C: | 2519 |
| Bildungsenergie / kJ mol-1: | 10.67 |
| Verdampfungsenergie / kJ mol-1: | 290.8 |
| Zerstäubungsenergie / kJ mol-1: | 324.01 |
| Erste ionisierungenergie / kJ mol-1: | 577.54 |
| Zweite ionisierungenergie / kJ mol-1: | 1816.69 |
| Dritte ionisierungenergie / kJ mol-1: | 2744.80 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 84100 |
| in den Ozeanen / ppm: | 0.01 |
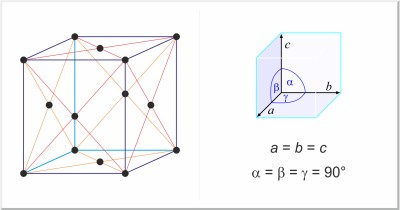
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=404.959 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 27Al | 26.9815384(1) | 100 |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Al3+ + 3e- → Al(s) | - 1.662 | |
| Al3+ + 2e- → Al+ | - 2.76 | |
| Al+ + e- → Al(s) | - 0.55 | |
| AlO2- + 4H+ + 3e- → Al(s) + 2H2O | - 1.262 | |
| Al(OH)3(s) + 3e- → Al(s) + 3OH- | - 2.31 | |
| AlF63- + 3e- → Al(s) + 6F- | - 2.07 |
| 12 Magnesium | ← | 13 Aluminium | → | 14 Silicium |
Zitieren dieser Seite:
Generalic, Eni. "Aluminium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/al.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
