KOHLENSTOFF
KOHLENSTOFFGRUPPE
| Ordnungszahl: | 6 |
| Elementgruppen: | 14 |
| Perioden: | 2 |
| Elektronenkonfiguration: | [He] 2s2 2p2 |
| Oxidationszustände: | -4 +2 +4 |
| Elekronegativität: | 2.55 |
| Atomradius / pm: | 77.2 |
| Relative atommasse: | [12.0096, 12.0116] |
Endeckung:- -
Das Elementsymbol C leitet sich von der lateinischen carbonium (Kohlenstoff) ab. Kohlenstoff tritt in drei Modifikationen auf, als hexagonaler Graphit, kubischer Diamant und in Form von Fullerenen. Chemisch gebunden findet sich Kohlenstoff als Hauptbestandteil von Kohle, Erdöl und Erdgas, die durch Inkohlung fossiler Biomasse entstanden sind. Kohlenstoff ist chemisch reaktionsträge, setzt sich aber bei höherer Temperatur mit Wasserstoff, Sauerstoff und zahlreichen Metallen um. Aufgrund seiner guten thermischen Leitfähigkeit und chemischen Widerstandsfähigkeit wird Graphit vor allem zur Herstellung von feuerfesten Schmelztiegeln, Gussformen und Ofenauskleidungen verwendet. Der weiche Graphit dient als Pulver zur Herstellung von Schmiermitteln und kompakt zur Herstellung von Bleistiftminen. Kohlenstoff ist in Form der Carbonate ein wichtiger Bestandteil gesteinsbildender Minerale. Als Kohlendioxid kommt Kohlenstoff im Wasser und in der Atmosphäre vor.
| Dichte / g dm-3: | 3513 | (diamant, 293 K) |
| 2260 | (graphit, 293 K) | |
| Atomvolumen / cm3mol-1: | 3.42 | (diamant, 293 K) |
| 5.31 | (graphit, 293 K) | |
| Elektrische widerstandskraft / µΩcm: | 1375 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 5.7 |
| Schmelzpunkt / °C: | 3550 |
| Siedepunkt / °C: | 4827 |
| Bildungsenergie / kJ mol-1: | 105 |
| Verdampfungsenergie / kJ mol-1: | 710.9 |
| Zerstäubungsenergie / kJ mol-1: | 711.2 |
| Erste ionisierungenergie / kJ mol-1: | 1086.46 |
| Zweite ionisierungenergie / kJ mol-1: | 2352.65 |
| Dritte ionisierungenergie / kJ mol-1: | 4620.50 |
| in der Atmosphäre / ppm: | 336.7 |
| in der Erdkruste / ppm: | 200 |
| in den Ozeanen / ppm: | 28 |
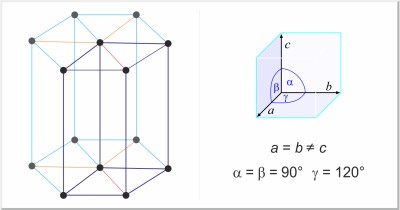
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=246.12, c=670.78 |
| Raumgruppe: | P63/mmc |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 12C | 12 | 98.90(3) |
| 13C | 13.003354838(1) | 1.10(3) |
| 14C | 14.003241988(4) | * |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| CO2(g) + 2H+ + 2e- → CO(g) + H2O | - 0.12 | |
| 2CO2(g) + 2H+ + 2e- → H2C2O4 | - 0.49 | |
| CO2(g) + 2H+ + 2e- → HCOOH | - 0.20 | |
| CNO- + 2H2O + 2e- → CN- + 2OH- | - 0.97 | |
| 2HCNO + 2H+ + 2e- → (CN)2(g) + 2H2O | +0.33 | |
| (CN)2(g) + 2H+ + 2e- → 2HCN | +0.37 | |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.699 | (quinon/hydroquinone) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 HCl) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 HClO4) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 H2SO4) |
| 5 Bor | ← | 6 Kohlenstoff | → | 7 Stickstoff |
Zitieren dieser Seite:
Generalic, Eni. "Kohlenstoff." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/c.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
