BOR
BORGRUPPE
| Ordnungszahl: | 5 |
| Elementgruppen: | 13 |
| Perioden: | 2 |
| Elektronenkonfiguration: | [He] 2s2 2p1 |
| Oxidationszustände: | +3 |
| Elekronegativität: | 2.04 |
| Atomradius / pm: | 79.5 |
| Relative atommasse: | [10.806, 10.821] |
Endeckung:1808 Sir Humphry Davy (GB); Joseph-Louis Gay-Lussac, Louis-Jaques Thénard (FR)
Der Name Bor leitet sich von arabisch Buraq und lateinischen borax. Es ist eine der härtesten Substanzen und bei Raumtemperatur sehr reaktionsträge; erst bei höheren Temperaturen reagiert es mit Halogenen und Sauerstoff. Bor ist ein wichtiges pflanzliches Spurenelement. In der Natur kommt Bor nicht elementar vor. Die wichtigsten Borminerale sind Borsäure und ihre Salze wie Borax (Natriumtetraborat). Bor wird technisch durch Reduktion von Bortrioxid mit Magnesium (amorphes Bor) hergestellt. Es wird zur Dotierung von Halbleitern, als Neutronenabsorber in Kernreaktoren, zur Herstellung von Borlegierungen, Borfasern und Whiskers verwendet. Borwasserstoffe (Borane) eignen sich für energiereiche Raketentreibstoffe.
| Dichte / g dm-3: | 2340 | (beta, 293 K) |
| Atomvolumen / cm3mol-1: | 4.62 | (beta, 293 K) |
| Elektrische widerstandskraft / µΩcm: | 1.8E+12 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 27 |
| Schmelzpunkt / °C: | 2075 |
| Siedepunkt / °C: | 4000 |
| Bildungsenergie / kJ mol-1: | 22.2 |
| Verdampfungsenergie / kJ mol-1: | 504.5 |
| Zerstäubungsenergie / kJ mol-1: | 557.64 |
| Erste ionisierungenergie / kJ mol-1: | 800.64 |
| Zweite ionisierungenergie / kJ mol-1: | 2427.09 |
| Dritte ionisierungenergie / kJ mol-1: | 3659.78 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 10 |
| in den Ozeanen / ppm: | 4.8 |
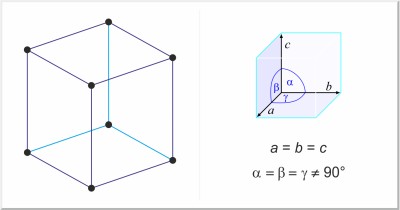
| Kristallstruktur: | rhomboedrisch |
| Gitterparameter der Elementarzelle / pm: | a=506.7, α=58°4' |
| Raumgruppe: | R3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 10B | 10.0129370(3) | 19.9(2) |
| 11B | 11.0093055(5) | 80.1(2) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| H3BO3 + 3H+ + 3e- → B(s) + 3H2O | - 0.869 | |
| H2BO3- + 4H+ + 3e- → B(s) + 3H2O | - 0.687 | |
| HBO32- + 5H+ + 3e- → B(s) + 3H2O | - 0.437 | |
| BO33- + 6H+ + 3e- → B(s) + 3H2O | - 0.165 | |
| B(OH)3 + 3H+ + 3e- → B(s) + 3H2O | - 0.87 | |
| BF4- + 3e- → B(s) + 4F- | - 1.04 | |
| H2B4O7 + 12H+ + 12e- → 4B(s) + 7H2O | - 0.836 | |
| B4O72- + 14H+ + 12e- → 4B(s) + 7H2O | - 0.792 |
| 4 Beryllium | ← | 5 Bor | → | 6 Kohlenstoff |
Zitieren dieser Seite:
Generalic, Eni. "Bor." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/b.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
