MAGNESIUM
ERDALKALIMETALLE
| Ordnungszahl: | 12 |
| Elementgruppen: | 2 |
| Perioden: | 3 |
| Elektronenkonfiguration: | [Ne] 3s2 |
| Oxidationszustände: | +2 |
| Elekronegativität: | 1.31 |
| Atomradius / pm: | 159.9 |
| Relative atommasse: | [24.304, 24.307] |
Endeckung:1808 Sir Humphry Davy (GB)
Der Name Magnesium leitet sich von Magnesia (Griechenland), einem Gebiet im östlichen Griechenland ab. Magnesium ist ein glänzt silberweiß Leichtmetall, überzieht sich an der Luft mit einer dünnen Oxidhaut (Passivierung) und verbrennt mit strahlend weißem Licht. Das Metall ist ein relativ häufiges Element, in elementarer Form kommt es in der Natur nicht vor. Magnesium wird durch Schmelzflusselektrolyse von wasserfreiem Magnesiumchlorid, MgCl2, bei etwa 700 °C gewonnen. Reines Magnesium findet in der Technik aufgrund der geringen Härte und der hohen Korrosionsanfälligkeit kaum Verwendung. Magnesiumlegierungen, z.B. mit Aluminium, zeichnen sich jedoch durch ihre geringe Dichte, ihre hohe Festigkeit und ihre Korrosionsbeständigkeit aus.
| Dichte / g dm-3: | 1738 | (293 K) |
| 1585 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 13.98 | (293 K) |
| 15.33 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 4.45 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 156 |
| Schmelzpunkt / °C: | 650 |
| Siedepunkt / °C: | 1090 |
| Bildungsenergie / kJ mol-1: | 9.04 |
| Verdampfungsenergie / kJ mol-1: | 127.6 |
| Zerstäubungsenergie / kJ mol-1: | 146.499 |
| Erste ionisierungenergie / kJ mol-1: | 737.76 |
| Zweite ionisierungenergie / kJ mol-1: | 1450.69 |
| Dritte ionisierungenergie / kJ mol-1: | 7732.75 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 32000 |
| in den Ozeanen / ppm: | 1300 |
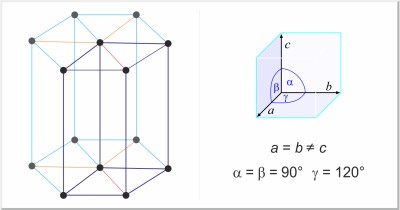
| Kristallstruktur: | hexagonal |
| Gitterparameter der Elementarzelle / pm: | a=320.94, c=521.03 |
| Raumgruppe: | P63/mmc |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 24Mg | 23.9850419(2) | 78.99(3) |
| 25Mg | 24.9858370(2) | 10.00(1) |
| 26Mg | 25.9825930(2) | 11.01(2) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Mg2+ + 2e- → Mg(s) | - 2.363 | |
| Mg(OH)2(s) + 2e- → Mg(s) + 2OH- | - 2.69 | |
| MgO(s) + 2H+ + 2e- → Mg(s) + H2O | - 1.722 |
| 11 Natrium | ← | 12 Magnesium | → | 13 Aluminium |
Zitieren dieser Seite:
Generalic, Eni. "Magnesium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/mg.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
