NATRIUM
ALKALIMETALLE
| Ordnungszahl: | 11 |
| Elementgruppen: | 1 |
| Perioden: | 3 |
| Elektronenkonfiguration: | [Ne] 3s1 |
| Oxidationszustände: | +1 |
| Elekronegativität: | 0.93 |
| Atomradius / pm: | 185.8 |
| Relative atommasse: | 22.989 769 28 (2) |
Endeckung:1807 Sir Humphry Davy (GB)
Der Name Natrium leitet sich vom Hebräischen 'neter' ab, was Soda bedeutet. Natrium ist ein silberweißes Alkalimetall, das an feuchter Luft sofort grau anläuft. Aufgrund seiner großen Reaktionsfähigkeit kommt es in der Natur jedoch nicht elementar vor. Die technische Gewinnung des Natriums erfolgt durch Schmelzflusselektrolyse v. a. von wasserfreiem Natriumchlorid oder auch von Natriumhydroxid. In großer Teil wird zur Herstellung von Natriumverbindungen verbraucht, flüssiges Natrium dient aufgrund seiner guten Wärmeleitfähigkeit als Kühlmittel in Kernreaktoren oder als Wärmeüberträger in Kraftwerken.
| Dichte / g dm-3: | 971 | (293 K) |
| 928 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 23.68 | (293 K) |
| 24.77 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 4.2 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 141 |
| Schmelzpunkt / °C: | 97.72 |
| Siedepunkt / °C: | 883 |
| Bildungsenergie / kJ mol-1: | 2.64 |
| Verdampfungsenergie / kJ mol-1: | 99.2 |
| Zerstäubungsenergie / kJ mol-1: | 107.566 |
| Erste ionisierungenergie / kJ mol-1: | 495.85 |
| Zweite ionisierungenergie / kJ mol-1: | 4562.48 |
| Dritte ionisierungenergie / kJ mol-1: | 6910.33 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 23000 |
| in den Ozeanen / ppm: | 10600 |
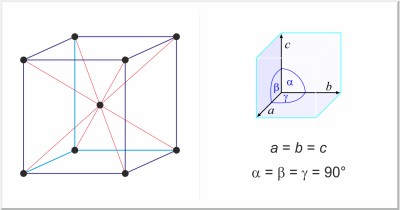
| Kristallstruktur: | kubisch-raumzentriert |
| Gitterparameter der Elementarzelle / pm: | a=429.06 |
| Raumgruppe: | Im3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 23Na | 22.9897697(2) | 100 |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Na+ + e- → Na(s) | - 2.714 |
| 10 Neon | ← | 11 Natrium | → | 12 Magnesium |
Zitieren dieser Seite:
Generalic, Eni. "Natrium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/na.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
