CALCIUM
ERDALKALIMETALLE
| Ordnungszahl: | 20 |
| Elementgruppen: | 2 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 4s2 |
| Oxidationszustände: | +2 |
| Elekronegativität: | 1 |
| Atomradius / pm: | 197.4 |
| Relative atommasse: | 40.078(4) |
Endeckung:1808 Sir Humphry Davy (GB)
Der Name Calcium leitet sich vom lateinischen Wort für Kalkstein "calx" ab. Calcium (bzw. Kalzium) ist ein silberweiß glänzendes, sehr weiches Leichtmetall, das sehr reaktionsfreudig ist. In Wasser löst sich Calcium unter Bildung von Wasserstoff auf. In elementarer Form kommt es in der Natur aufgrund der großen Reaktionsfähigkeit nicht vor. Die großtechnische Herstellung erfolgt heute jedoch durch eine Redoxreaktion mit Aluminium und gebranntem Kalk. Elementares Calcium dient zur Herstellung von Metallen wie Chrom, Vanadium, Plutonium oder Uran aus Erzen. In der Metallindustrie dienen Calciumlegierungen als Desoxidationsmittel und zur Entschwefelung oder Entkohlung von Roheisen oder Stählen.
| Dichte / g dm-3: | 1550 | (293 K) |
| 1365 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 25.86 | (293 K) |
| 29.36 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 3.91 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 190 |
| Schmelzpunkt / °C: | 842 |
| Siedepunkt / °C: | 1484 |
| Bildungsenergie / kJ mol-1: | 9.33 |
| Verdampfungsenergie / kJ mol-1: | 150.6 |
| Zerstäubungsenergie / kJ mol-1: | 177.74 |
| Erste ionisierungenergie / kJ mol-1: | 589.83 |
| Zweite ionisierungenergie / kJ mol-1: | 1145.46 |
| Dritte ionisierungenergie / kJ mol-1: | 4912.40 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 52900 |
| in den Ozeanen / ppm: | 400 |
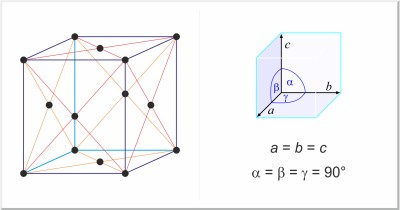
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=558.84 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 40Ca | 39.9625911(3) | 96.941(18) |
| 42Ca | 41.9586183(4) | 0.647(9) |
| 43Ca | 42.9587668(5) | 0.135(6) |
| 44Ca | 43.9554811(9) | 2.086(12) |
| 46Ca | 45.953693(3) | 0.004(3) |
| 48Ca | 47.952534(4) | 0.187(4) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Ca2+ + 2e- → Ca(s) | - 2.866 | |
| CaO + 2H+ + 2e- → Ca(s) + H2O | - 1.90 | |
| Ca(OH)2(s) + 2e- → Ca(s) + 2OH- | - 3.03 |
| 19 Kalium | ← | 20 Calcium | → | 21 Scandium |
Zitieren dieser Seite:
Generalic, Eni. "Calcium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/ca.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
