ARSEN
STICKSTOFFGRUPPE
| Ordnungszahl: | 33 |
| Elementgruppen: | 15 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d10 4s2 4p3 |
| Oxidationszustände: | -3 +3 +5 |
| Elekronegativität: | 2.18 |
| Atomradius / pm: | 124.5 |
| Relative atommasse: | 74.921 595(6) |
Endeckung:1250 Albertus Magnus (DE)
Der Name Arsen stammt von der griechischen Bezeichnung arsenikon, die Bezeichnung des Arsenminerals Auripigment. Arsen kommt in mehreren Modifikationen vor: Graues Arsen ist die bei Raumtemperatur stabile, metallisch glänzende Form. Schwarzes, amorphes Arsen entsteht beim Abkühlen von Arsendampf an 100-200°C warmen Flächen. In elementarer Form kommt es in der Natur nur in geringen Mengen als gediegenes Arsen vor. Die Herstellung erfolgt durch das Erhitzen von Arsenkies unter Luftabschluss bei 700°C. Metallisches Arsen wird vorwiegend in Blei- und Kupferlegierungen beigemischt, um die Verformbarkeit oder die Härte zu erhöhen. Arsen und seine Verbindungen sind sehr giftig.
| Dichte / g dm-3: | 5780 | (alpha, 293 K) |
| 4700 | (beta, 293 K) | |
| Atomvolumen / cm3mol-1: | 12.96 | (alpha, 293 K) |
| 15.94 | (beta, 293 K) | |
| Elektrische widerstandskraft / µΩcm: | 33.3 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 50 |
| Schmelzpunkt / °C: | 817 |
| Siedepunkt / °C: | 614 |
| Bildungsenergie / kJ mol-1: | 27.7 |
| Verdampfungsenergie / kJ mol-1: | 31.9 |
| Zerstäubungsenergie / kJ mol-1: | 301.42 |
| Erste ionisierungenergie / kJ mol-1: | 944.46 |
| Zweite ionisierungenergie / kJ mol-1: | 1797.82 |
| Dritte ionisierungenergie / kJ mol-1: | 2735.48 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 1 |
| in den Ozeanen / ppm: | 0.003 |
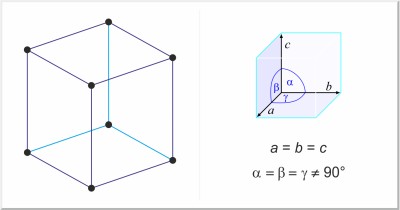
| Kristallstruktur: | rhomboedrisch |
| Gitterparameter der Elementarzelle / pm: | a=413.18, α=54°10' |
| Raumgruppe: | R3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 75As | 74.921596(2) | 100 |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| H3AsO4 + 3H+ + 2e- → AsO+ + 3H2O | +0.55 | |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.559 | |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.577 | (1 mol dm-3 HCl) |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.577 | (1 mol dm-3 HClO4) |
| H2AsO4- + 3H+ + 2e- → H3AsO3 + H2O | +0.666 | |
| HAsO42- + 4H+ + 2e- → H3AsO3 + H2O | +0.881 | |
| HAsO42- + 3H+ + 2e- → H2AsO3- + H2O | +0.609 | |
| AsO43- + 3H2O + 2e- → H2AsO3- + 4OH- | - 0.67 | |
| 2H3AsO4 + 4H+ + 4e- → As2O3(s) + 5H2O | +0.58 | |
| 2H2AsO4- + 6H+ + 4e- → As2O3(s) + 5H2O | +0.687 | |
| 2HAsO42- + 8H+ + 4e- → As2O3(s) + 5H2O | +0.901 | |
| 2AsO43- + 10H+ + 4e- → As2O3(s) + 5H2O | +1.27 | |
| AsO43- + 8H+ + 5e- → As(s) + 4H2O | +0.648 | |
| As2O3(s) + 6H+ + 6e- → 2As(s) + 3H2O | +0.234 | |
| AsO+ + 2H+ + 3e- → As(s) + H2O | +0.254 | |
| H3AsO3 + 3H+ + 3e- → As(s) + 3H2O | +0.248 | |
| H2AsO3- + 4H+ + 3e- → As(s) + 3H2O | +0.429 | |
| H2AsO3- + H2O + 3e- → As(s) + 4OH- | - 0.68 | |
| As(s) + 3H+ + 3e- → AsH3(g) | - 0.608 |
| 32 Germanium | ← | 33 Arsen | → | 34 Selen |
Zitieren dieser Seite:
Generalic, Eni. "Arsen." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/as.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
