ANTIMON
STICKSTOFFGRUPPE
| Ordnungszahl: | 51 |
| Elementgruppen: | 15 |
| Perioden: | 5 |
| Elektronenkonfiguration: | [Kr] 4d10 5s2 5p3 |
| Oxidationszustände: | -3 +3 +5 |
| Elekronegativität: | 2.05 |
| Atomradius / pm: | 145 |
| Relative atommasse: | 121.760(1) |
Endeckung:- -
Das Elementsymbol Sn stammt vom lateinischen stibium. Der Name stammt von dem griechischen Wort anti monos (Gegner des Alleinseins), weil das Element immer zusammen mit anderen auftritt. Das zinnweiß glänzende graue Antimon ist die metallische Modifikation des Elements. Es lässt sich aufgrund der geringen Härte und seiner Sprödigkeit leicht pulverisieren. In der Natur kommt es im gediegenen Zustand vor. Sehr reines Antimon erhält man durch elektrolytische Raffination oder durch die Reduktion von Antimon(III)-chlorid mit Wasserstoff. Aufgrund seiner Sprödigkeit besitzt das Element nur eine geringe technische Bedeutung. Technische Bedeutung hat Antimon u. a. als härtender Legierungszusatz, seine Verbindungen dienen zur Herstellung von Zündhölzern (Antimonsulfid) und Farbstoffen.
| Dichte / g dm-3: | 6691 | (293 K) |
| 6483 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 18.20 | (293 K) |
| 18.78 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 39 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 24.3 |
| Schmelzpunkt / °C: | 630.63 |
| Siedepunkt / °C: | 1587 |
| Bildungsenergie / kJ mol-1: | 20.9 |
| Verdampfungsenergie / kJ mol-1: | 165.8 |
| Zerstäubungsenergie / kJ mol-1: | 262.04 |
| Erste ionisierungenergie / kJ mol-1: | 830.59 |
| Zweite ionisierungenergie / kJ mol-1: | 1594.96 |
| Dritte ionisierungenergie / kJ mol-1: | 2441.10 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.2 |
| in den Ozeanen / ppm: | 0.0005 |
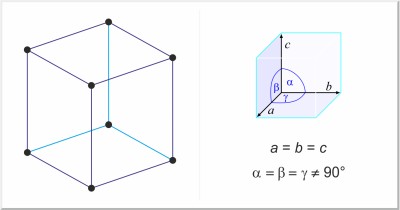
| Kristallstruktur: | rhomboedrisch |
| Gitterparameter der Elementarzelle / pm: | a=430.84, c=1124.7 |
| Raumgruppe: | R3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 121Sb | 120.903818(2) | 57.36(8) |
| 123Sb | 122.904216(2) | 42.64(8) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| SbV + 2e- → SbIII | +0.818 | (6 mol dm-3 HCl) |
| SbV + 2e- → SbIII | +0.746 | (3.5 mol dm-3 HCl) |
| SbO+ + 2H+ + 3e- → Sb(s) + H2O | +0.212 | |
| SbO3- + 2H+ + 2e- → SbO2- + H2O | +0.353 | |
| SbO3- + 3H+ + 2e- → HSbO2 + H2O | +0.678 | |
| SbO3- + 4H+ + 2e- → SbO+ + 2H2O | +0.704 | |
| SbO2- + 2H+ + 2e- → SbO- + H2O | +0.720 | |
| 2SbO3- + 6H+ + 4e- → Sb2O3(s) + 3H2O | +0.772 | |
| SbO2- + 4H+ + 3e- → Sb(s) + 2H2O | +0.446 | |
| HSbO2 + 3H+ + 3e- → Sb(s) + 2H2O | +0.230 | |
| Sb2O3(s) + 6H+ + 6e- → 2Sb(s) + 3H2O | +0.152 | |
| Sb2O5(s) + 6H+ + 4e- → 2SbO+ + 3 H2O | +0.581 | |
| Sb2O5(s) + 4H+ + 4e- → Sb2O3(s) + 2H2O | +0.692 | |
| Sb(s) + 3H+ + 3e- → SbH3(g) | - 0.510 |
Zitieren dieser Seite:
Generalic, Eni. "Antimon." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/sb.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
