BLEI
KOHLENSTOFFGRUPPE
| Ordnungszahl: | 82 |
| Elementgruppen: | 14 |
| Perioden: | 6 |
| Elektronenkonfiguration: | [Xe] 4f14 5d10 6s2 6p2 |
| Oxidationszustände: | +2 +4 |
| Elekronegativität: | 1.8 |
| Atomradius / pm: | 175 |
| Relative atommasse: | 207.2(1) |
Endeckung:- -
Das Elementsymbol Pb stammt von dem lateinischen Wort plumbum (Blei). Der Name Blei ist indogermanischen Ursprungs und bedeutet soviel wie schimmernd, leuchtend oder glänzend. Blei ist ein bläulich-graues, sehr gut dehnbares Schwermetall. Das Metall wird hauptsächlich aus Bleiglanz gewonnen. Blei wird aus sulfidischen Erzen meist nach dem Röstreduktionsverfahren gewonnen, wobei das Bleisulfid zu Bleioxid und Schwefeldioxid geröstet (Rösten) und anschließend mit Kohle im Schachtofen zu unreinem Blei (Rohblei, Werkblei) reduziert wird. Verwendet wird Blei zur Herstellung von Akkumulatoren (rund 70 % des Gesamtverbrauchs), Kabelmänteln, Rohren, Farben und Gefäßen für aggressive Flüssigkeiten, als Legierungsmaterial sowie im Strahlenschutz zur Absorption von Röntgen- und Gammastrahlen.
| Dichte / g dm-3: | 11350 | (293 K) |
| 10678 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 18.26 | (293 K) |
| 19.40 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 20.648 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 35.3 |
| Schmelzpunkt / °C: | 327.46 |
| Siedepunkt / °C: | 1749 |
| Bildungsenergie / kJ mol-1: | 5.121 |
| Verdampfungsenergie / kJ mol-1: | 177.8 |
| Zerstäubungsenergie / kJ mol-1: | 195.74 |
| Erste ionisierungenergie / kJ mol-1: | 715.60 |
| Zweite ionisierungenergie / kJ mol-1: | 1450.40 |
| Dritte ionisierungenergie / kJ mol-1: | 3081.50 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 8 |
| in den Ozeanen / ppm: | 0.003 |
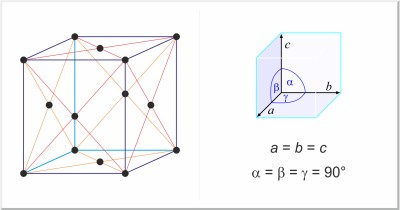
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=495.00 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 204Pb | 203.973029(3) | 1.4(1) |
| 206Pb | 205.974449(3) | 24.1(1) |
| 207Pb | 206.975881(3) | 22.1(1) |
| 208Pb | 207.976636(3) | 52.4(1) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Pb4+ + 2e- → Pb2+ | +1.694 | |
| Pb2+ + 2e- → Pb(s) | - 0.126 | |
| Pb2+ + 2e- → Pb(s) | - 0.14 | (1 mol dm-3 HClO4) |
| Pb2+ + 2e- → Pb(s) | - 0.29 | (1 mol dm-3 H2SO4) |
| 3PbO2(s) + 2H2O + 4e- → Pb3O4(s) + 4OH- | +0.295 | |
| PbO2(s) + 4H+ + 2e- → Pb2+ + 2H2O | +1.455 | |
| PbO2(s) + 4H+ + SO42- + 2e- → PbSO4(s) + 2H2O | +1.685 | |
| PbO2(s) + H+ + 2e- → HPbO2- | +0.621 | |
| 3PbO32- + 10H+ + 4e- → Pb3O4(s) + 5H2O | +2.515 | |
| PbO32- + 4H+ + 2e- → PbO(s) + 2H2O | +2.001 | |
| PbO32- + 3H+ + e- → HPbO2- + H2O | +1.547 | |
| PbO32- + 6H+ + 2e- → Pb2+ + 3H2O | +2.375 | |
| Pb3O4(s) + H2O + 2e- → 3PbO(s) + 2OH- | +0.249 | |
| Pb3O4(s) + 8H+ + 2e- → 3Pb2+ + 3H2O | +2.094 | |
| Pb3O4(s) + 2H2O + 2e- → 3HPbO2- + H+ | - 0.390 | |
| PbO(s) + 2H+ + 2e- → Pb(s) + H2O | +0.249 | |
| PbSO4 + 2e- → Pb(s) + SO42- | - 0.350 | |
| HPbO2- + 3H+ + 2e- → Pb(s) + 2H2O | +0.702 | |
| Pb(s) + 2H+ + 2e- → PbH2 | - 1.507 |
| 81 Thallium | ← | 82 Blei | → | 83 Bismut |
Zitieren dieser Seite:
Generalic, Eni. "Blei." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/pb.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
