CARBONO
GRUPO DEL CARBONO
| Número atómico: | 6 |
| Grupo: | 14 |
| Periodo: | 2 |
| Configuración electrónica: | [He] 2s2 2p2 |
| Estados de oxidación: | -4 +2 +4 |
| Electronegatividad: | 2.55 |
| Radio atómico / pm: | 77.2 |
| Masa atómica relativa: | [12.0096, 12.0116] |
El carbono se conoce desde la antigüedad. El término Carbono procede del latín carbo que significa carbón de leña. Dependiendo de las condiciones de formación, puede encontrarse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante. El grafito se combina con arcilla para fabricar las minas de los lápices. Además se utiliza como aditivo en lubricantes. El diamante se emplea para la construcción de joyas y como material de corte aprovechando su dureza. Constituye la base de todos los procesos vitales y se encuentra en una variedad casi infinita de combinaciones. En combinaciones con otros elementos, el carbono es un elemento ampliamente distribuido en la naturaleza, donde existe principalmente en forma de carbonatos. El dióxido de carbono es un componente importante de la atmósfera.
| Densidad / g dm-3: | 3513 | (diamante, 293 K) |
| 2260 | (grafito, 293 K) | |
| Volumen molar / cm3mol-1: | 3.42 | (diamante, 293 K) |
| 5.31 | (grafito, 293 K) | |
| Resistencia eléctrica / µΩcm: | 1375 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 5.7 |
| Punto de fusión / °C: | 3550 |
| Punto de ebullición / °C: | 4827 |
| Calor de fusión / kJ mol-1: | 105 |
| Calor de vaporización / kJ mol-1: | 710.9 |
| Calor de atomización / kJ mol-1: | 711.2 |
| Primera energía de ionización / kJ mol-1: | 1086.46 |
| Segunda energía de ionización / kJ mol-1: | 2352.65 |
| Tercera energía de ionización / kJ mol-1: | 4620.50 |
| en la atmósfera / ppm: | 336.7 |
| en la corteza terrestre / ppm: | 200 |
| en los océanos / ppm: | 28 |
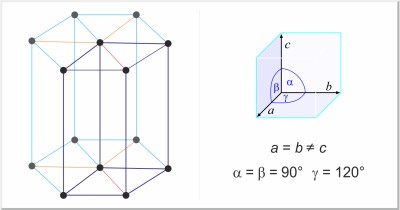
| Estructura cristalina: | hexagonal |
| Dimensiones de la celda unidad / pm: | a=246.12, c=670.78 |
| Grupo espacial: | P63/mmc |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 12C | 12 | 98.90(3) |
| 13C | 13.003354838(1) | 1.10(3) |
| 14C | 14.003241988(4) | * |
| Semirreacción | Eo / V | |
|---|---|---|
| CO2(g) + 2H+ + 2e- → CO(g) + H2O | - 0.12 | |
| 2CO2(g) + 2H+ + 2e- → H2C2O4 | - 0.49 | |
| CO2(g) + 2H+ + 2e- → HCOOH | - 0.20 | |
| CNO- + 2H2O + 2e- → CN- + 2OH- | - 0.97 | |
| 2HCNO + 2H+ + 2e- → (CN)2(g) + 2H2O | +0.33 | |
| (CN)2(g) + 2H+ + 2e- → 2HCN | +0.37 | |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.699 | (quinon/hydroquinone) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 HCl) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 HClO4) |
| C6H4O2 + 2H+ + 2e- → C6H4(OH)2 | +0.696 | (1 mol dm-3 H2SO4) |
| 5 Boro | ← | 6 Carbono | → | 7 Nitrógeno |
Citación de esta página:
Generalic, Eni. "Carbono." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/es/c.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
