FLUOR
HALOGENI ELEMENT
| Atomski broj: | 9 |
| Skupina: | 17 |
| Perioda: | 2 |
| Elektronska konfiguracija: | [He] 2s2 2p5 |
| Oksidacijski broj: | -1 |
| Elektronegativnost: | 3.98 |
| Atomski radijus / pm: | 70.9 |
| Relativna atomska masa: | 18.998 403 163(6) |
Fluor je 1886. godine otkrio Henri Moissan (FR). Ime mu dolazi od latinske riječi fluere što znači teći jer se njegov mineral fluorit (CaF2) upotrebljavao za snižavanje točke topljenja. To je svjetložuti do zelenkasti plin s oštrim nadražujućim mirisom. Najreaktivniji je od svih elemenata i može oksidirati gotovo sve što dođe s njim u dodir. Fluor je jako otrovan plin. Nadražuje na dodir. Fluor se u prirodi pojavljuje samo u spojevima, od kojih su najvažniji fluorit (CaF2), kriolit (Na3AlF6) i fluorapatit (Ca5(PO4)3F). Dobiva se elektrolizom kalij fluorida u bezvodnom fluorovodiku. Primjenjuje se za punjenje rashladnih uređaja (freon) i polimerizaciju u politetrafluoretilen (PTFE).
| Gustoća / g dm-3: | 1516 | (tekuće stanje, 85 K) |
| 1.696 | (plinovito stanje, 273 K) | |
| Molarni volumen / cm3mol-1: | 12.53 | (tekuće stanje, 85 K) |
| 22403.78 | (plinovito stanje, 273 K) | |
| Električna otpornost / µΩcm: | - | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 0.0256 |
| Temperatura taljenja / °C: | -219.62 |
| Temperatura vrenja / °C: | -188.12 |
| Toplina taljenja / kJ mol-1: | 1.02 |
| Toplina isparavanja / kJ mol-1: | 3.26 |
| Toplina atomiziranja / kJ mol-1: | 76.9 |
| Prva energija ionizacije / kJ mol-1: | 1681.06 |
| Druga energija ionizacije / kJ mol-1: | 3374.20 |
| Treća energija ionizacije / kJ mol-1: | 6050.48 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 625 |
| u oceanima / ppm: | 1.3 |
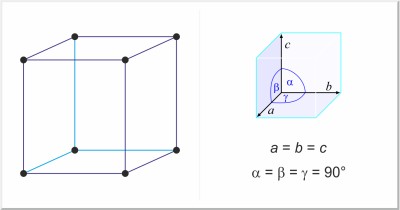
| Kristalna struktura: | jednostavna kubična |
| Dimenzije jedinične ćelije / pm: | a=667 |
| Prostorna grupa: | Pm3n |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 19F | 18.99840321(8) | 100 |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| F2(g) + 2e- → 2F- | +2.87 | |
| F2(g) + 2H+ + 2e- → 2HF | +2.81 | |
| F2(g) + 2H+ + 2e- → 2HF(aq) | +3.06 | |
| F2O + 4H+ + 4e- → 2HF + H2O | +2.12 | |
| F2O + 2H+ + 4e- → 2F- + H2O | +2.15 | |
| F2O + 2H+ + 2e- → F2(g) + H2O | +1.44 |
Citiranje ove stranice:
Generalić, Eni. "Fluor." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 15 Apr. 2025. <https://www.periodni.com/hr/f.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
