KLOR
HALOGENI ELEMENT
| Atomski broj: | 17 |
| Skupina: | 17 |
| Perioda: | 3 |
| Elektronska konfiguracija: | [Ne] 3s2 3p5 |
| Oksidacijski broj: | -1 +1 +5 +7 |
| Elektronegativnost: | 3.16 |
| Atomski radijus / pm: | 99.4 |
| Relativna atomska masa: | [35.446, 35.457] |
Klor je 1774. godine otkrio Carl William Scheele (SE). Ime je dobio od grčke riječi chloros što znači žutozelen. To je žuto-zeleni, gust, nadražujući plin iritirajućeg mirisa koji se dobro otapa u vodi. U prirodi ga nema slobodnog i javlja se skoro isključivo u obliku klorida. Klor je otrovan plin koji, ako se udiše, izaziva kašalj i nagriza organe za disanje. Pri dužem udisanju dovodi do smrti. Jako nadražuje kožu pri kontaktu. Klor je u velikim količinama prisutan u morskoj vodi. U prirodi se nalazi kao kamena sol (NaCl), silvin (KCl). Industrijski se proizvodi isključivo elektrolizom koncentrirane otopine natrij klorida. Upotrebljava se za dezinfekciju, bijeljenje i sintezu različitih spojeva.
| Gustoća / g dm-3: | 2030 | (113 K) |
| 1507 | (239 K) | |
| 3.214 | (273 K) | |
| Molarni volumen / cm3mol-1: | 17.46 | (113 K) |
| 23.53 | (239 K) | |
| 22061.61 | (273 K) | |
| Električna otpornost / µΩcm: | - | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 0.0089 |
| Temperatura taljenja / °C: | -101.5 |
| Temperatura vrenja / °C: | -34.04 |
| Toplina taljenja / kJ mol-1: | 6.41 |
| Toplina isparavanja / kJ mol-1: | 20.4033 |
| Toplina atomiziranja / kJ mol-1: | 120 |
| Prva energija ionizacije / kJ mol-1: | 1251.20 |
| Druga energija ionizacije / kJ mol-1: | 2297.72 |
| Treća energija ionizacije / kJ mol-1: | 3821.81 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 130 |
| u oceanima / ppm: | 19000 |
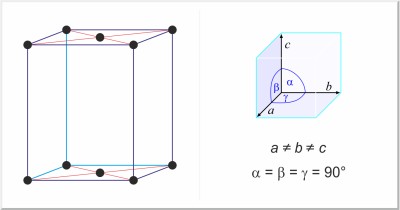
| Kristalna struktura: | bazno centrirana ortorompska |
| Dimenzije jedinične ćelije / pm: | a=624, b=448, c=826 |
| Prostorna grupa: | Cmca |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 35Cl | 34.96885271(4) | 75.77(7) |
| 37Cl | 36.96590260(5) | 24.23(7) |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| Cl2(g) + 2e- → 2Cl- | +1.359 | |
| Cl2(aq) + 2e- → 2Cl- | +1.39 | |
| ClO4- + 2H+ + 2e- → ClO3- + H2O | +1.19 | |
| ClO4- + H2O + 2e- → ClO3- + 2OH- | +0.36 | |
| 2ClO4- + 16H+ + 14e- → Cl2(g) + 8H2O | +1.39 | |
| ClO3- + 3H+ + 2e- → HClO2 + H2O | +1.21 | |
| ClO3- + H2O + 2e- → ClO2- + 2OH- | +0.33 | |
| 2ClO3- + 12H+ + 10e- → Cl2(g) + 3H2O | +1.47 | |
| HClO2 + 2H+ + 2e- → HClO + H2O | +1.64 | |
| ClO2- + H2O + 2e- → ClO- + 2OH- | +0.66 | |
| 2HClO + 2H+ + 2e- → Cl2(g) + H2O | +1.63 | |
| 2ClO- + 2H2O + 2e- → Cl2(g) + 4OH- | +0.40 |
Citiranje ove stranice:
Generalić, Eni. "Klor." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/hr/cl.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
