SELENIJ
HALKOGENI ELEMENT
| Atomski broj: | 34 |
| Skupina: | 16 |
| Perioda: | 4 |
| Elektronska konfiguracija: | [Ar] 3d10 4s2 4p4 |
| Oksidacijski broj: | -2 +4 +6 |
| Elektronegativnost: | 2.55 |
| Atomski radijus / pm: | 116 |
| Relativna atomska masa: | 78.971(8) |
Selenij je 1817. godine otkrio Jöns Jacob Berzelius (SE). Ime je dobio po grčkom nazivu za Mjesec - selene. To je amorfna ili kristalična crvena do siva krutina neugodnog mirisa koji se upije u kožu i teško odstranjuje. Ne reagira s vodom. Topljiv u alkalijama i nitratnoj kiselini. Gori na zraku. Metalni selenij je slab vodič električne struje, ali mu se vodljivost na svjetlu povećava i do tisuću puta. Selenij je otrovan ako se udiše ili proguta. Ima kumulativni efekt. Nadražuje kožu i vjerojatno je kancerogen. Selenij je redoviti pratitelj sumpora. Dobiva se kao sporedni proizvod pri proizvodnji bakra (prženjem sulfidnih ruda). Upotrebljava se za izradu fotoelektričnih ćelija (osobito za fotokopiranje), u staklarskoj industriji za uklanjanje zelene boje i proizvodnji gume. Cijena amorfnog selenija u kuglicama čistoće 99.999% iznosi 301.80 € za 1000 g.
| Gustoća / g dm-3: | 4790 | (sivi, 293 K) |
| 3987 | (t.t.) | |
| Molarni volumen / cm3mol-1: | 16.48 | (sivi, 293 K) |
| 19.80 | (t.t.) | |
| Električna otpornost / µΩcm: | 12 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 2.04 |
| Temperatura taljenja / °C: | 221 |
| Temperatura vrenja / °C: | 685 |
| Toplina taljenja / kJ mol-1: | 5.1 |
| Toplina isparavanja / kJ mol-1: | 90 |
| Toplina atomiziranja / kJ mol-1: | 226.4 |
| Prva energija ionizacije / kJ mol-1: | 940.97 |
| Druga energija ionizacije / kJ mol-1: | 2044.54 |
| Treća energija ionizacije / kJ mol-1: | 2973.74 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 0.05 |
| u oceanima / ppm: | - |
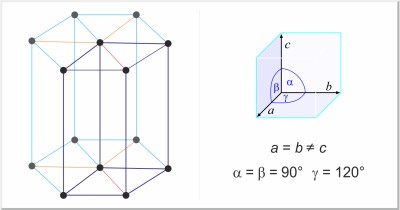
| Kristalna struktura: | heksagonska |
| Dimenzije jedinične ćelije / pm: | a=436.56, c=495.90 |
| Prostorna grupa: | P3121 |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 74Se | 73.922477(2) | 0.89(2) |
| 76Se | 75.919214(2) | 9.36(11) |
| 77Se | 76.919915(2) | 7.63(6) |
| 78Se | 77.917310(2) | 23.78(9) |
| 80Se | 79.916522(2) | 49.61(10) |
| 82Se | 81.916700(2) | 8.73(6) |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| SeO42- + 2H+ + 2e- → SeO32- + H2O | +0.880 | |
| SeO42- + H2O + 2e- → SeO32- + 2OH- | +0.05 | |
| SeO42- + 3H+ + 2e- → HSeO3- + H2O | +1.075 | |
| SeO42- + 4H+ + 2e- → H2SeO3 + H2O | +1.15 | |
| HSeO4- + 3H+ + 2e- → H2SeO3 + H2O | +1.090 | |
| SeO32- + 6H+ + 4e- → Se(s) + 3H2O | +0.875 | |
| HSeO3- + 5H+ + 4e- → Se(s) + 3H2O | +0.778 | |
| H2SeO3 + 4H+ + 4e- → Se(s) + 3H2O | +0.740 | |
| SeO32- + 6H+ + 6e- → Se2- + 3H2O | +0.276 | |
| SeO32- + 7H+ + 6e- → HSe- + 3H2O | +0.414 | |
| HSeO3- + 6H+ + 6e- → HSe- + 3H2O | +0.349 | |
| HSeO3- + 7H+ + 6e- → H2Se(g) + 3H2O | +0.386 | |
| H2SeO3 + 6H+ + 6e- → H2Se(g) + 3H2O | +0.360 | |
| Se(s) + 2H+ + 2e- → H2Se(g) | - 0.369 | |
| Se(s) + 2e- → Se2- | - 0.924 | |
| Se(s) + H+ + 2e- → HSe- | - 0.510 | |
| Se(s) + 2H+ + 2e- → H2Se(g) | - 0.399 |
Citiranje ove stranice:
Generalić, Eni. "Selenij." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/hr/se.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
