ANTIMON
DUŠIKOVA SKUPINA
| Atomski broj: | 51 |
| Skupina: | 15 |
| Perioda: | 5 |
| Elektronska konfiguracija: | [Kr] 4d10 5s2 5p3 |
| Oksidacijski broj: | -3 +3 +5 |
| Elektronegativnost: | 2.05 |
| Atomski radijus / pm: | 145 |
| Relativna atomska masa: | 121.760(1) |
Antimon je poznat od davnih vremena. Ime mu dolazi od grčkih riječi anti i monos što znači onaj koji ne dolazi sam. Simbol dolazi od latinskog naziva za antimonov sulfid - stibium. Žuti nemetalni antimon je nestabilna alotropska modifikacija koja lako prelazi u stabilni sivi metalni antimon. Sivi antimon ima svojstvo da mu se volumen pri taljenju smanjuje. Na zraku je stabilan ali ako se zagrije izgara. Lako se otapa u oksidirajućim kiselinama. Antimon i njegovi spojevi su toksični. Nadražuje na dodir. Glavna ruda za proizvodnju antimona je stibinit (Sb2S3). Upotrebljava se kao legirni element za olovo i kositar. Cijena antimona u obliku ingota čistoće 99.9% iznosi 153.50 € za 450 g.
| Gustoća / g dm-3: | 6691 | (293 K) |
| 6483 | (t.t.) | |
| Molarni volumen / cm3mol-1: | 18.20 | (293 K) |
| 18.78 | (t.t.) | |
| Električna otpornost / µΩcm: | 39 | (20 °C) |
| Toplinska vodljivost / W m-1K-1: | 24.3 |
| Temperatura taljenja / °C: | 630.63 |
| Temperatura vrenja / °C: | 1587 |
| Toplina taljenja / kJ mol-1: | 20.9 |
| Toplina isparavanja / kJ mol-1: | 165.8 |
| Toplina atomiziranja / kJ mol-1: | 262.04 |
| Prva energija ionizacije / kJ mol-1: | 830.59 |
| Druga energija ionizacije / kJ mol-1: | 1594.96 |
| Treća energija ionizacije / kJ mol-1: | 2441.10 |
| u atmosferi / ppm: | - |
| u Zemljinoj kori / ppm: | 0.2 |
| u oceanima / ppm: | 0.0005 |
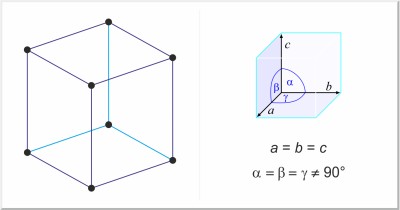
| Kristalna struktura: | romboedarska |
| Dimenzije jedinične ćelije / pm: | a=430.84, c=1124.7 |
| Prostorna grupa: | R3m |
| Izotop | Relativna atomska masa | Maseni udio (%) |
|---|---|---|
| 121Sb | 120.903818(2) | 57.36(8) |
| 123Sb | 122.904216(2) | 42.64(8) |
| Uravnotežena polureakcija | Eo / V | |
|---|---|---|
| SbV + 2e- → SbIII | +0.818 | (6 mol dm-3 HCl) |
| SbV + 2e- → SbIII | +0.746 | (3.5 mol dm-3 HCl) |
| SbO+ + 2H+ + 3e- → Sb(s) + H2O | +0.212 | |
| SbO3- + 2H+ + 2e- → SbO2- + H2O | +0.353 | |
| SbO3- + 3H+ + 2e- → HSbO2 + H2O | +0.678 | |
| SbO3- + 4H+ + 2e- → SbO+ + 2H2O | +0.704 | |
| SbO2- + 2H+ + 2e- → SbO- + H2O | +0.720 | |
| 2SbO3- + 6H+ + 4e- → Sb2O3(s) + 3H2O | +0.772 | |
| SbO2- + 4H+ + 3e- → Sb(s) + 2H2O | +0.446 | |
| HSbO2 + 3H+ + 3e- → Sb(s) + 2H2O | +0.230 | |
| Sb2O3(s) + 6H+ + 6e- → 2Sb(s) + 3H2O | +0.152 | |
| Sb2O5(s) + 6H+ + 4e- → 2SbO+ + 3 H2O | +0.581 | |
| Sb2O5(s) + 4H+ + 4e- → Sb2O3(s) + 2H2O | +0.692 | |
| Sb(s) + 3H+ + 3e- → SbH3(g) | - 0.510 |
| 50 Kositar | ← | 51 Antimon | → | 52 Telurij |
Citiranje ove stranice:
Generalić, Eni. "Antimon." EniG. Periodni sustav elemenata. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/hr/sb.html>.
Članci i tablice
- Periodni sustav
- Home
- Kratki oblik tablice periodnog sustava
- Dugi oblik tablice periodnog sustava
- Povijest periodnog sustava kemijskih elemenata
- Printabilni periodni sustav
- Elektronske konfiguracije elemenata
- Abecedni popis kemijskih elemenata
- Imenovanje elemenata s atomskim brojem većim od 100
- ASCII Periodni sustav
- Online kalkulatori
- Znanstveno računalo (kalkulator) za kemičare
- Kalkulator plinskih zakona
- Kalkulator molarne mase
- Pretvaranje kutova
- Pretvaranje rimskih brojeva u arapske
- Pretvaranje brojevnih sustava
- Priprema otopina
- Označavanje kemijskih posuda
- Kalkulator oksidacijskih brojeva
- ARS metoda
- Metoda promjene oksidacijskih brojeva
- Ion-elektron metoda
- Gaussova metoda eliminacije
- Igra memorije
- Pronađi parove
- Članci i tablice
- Kemija
- Lista kratica i akronima
- Kristalni sustavi i Bravaisove rešetke
- GHS - Piktogrami opasnosti
- NFPA 704 dijamant opasnosti
- Temeljne fizikalne konstante
- Konstante produkta topljivosti
- SI - Međunarodni sustav mjernih jedinica
- Sastav smjesa i otopina
- Stehiometrijski račun
- Klorinitet i slanost mora
- Elementi rijetkih zemalja (REE)
- Izjednačavanje kemijskih jednadžbi
- Teorija valentne veze
- Ekologija
- Web dizajn
- Kemijski rječnik
- Kemija
- Download
- ≡ Meni
