CHROM
UEBERGANGSELEMENTE: CHROMGRUPPE
| Ordnungszahl: | 24 |
| Elementgruppen: | 6 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d5 4s1 |
| Oxidationszustände: | +2 +3 +6 |
| Elekronegativität: | 1.66 |
| Atomradius / pm: | 124.9 |
| Relative atommasse: | 51.9961(6) |
Endeckung:1797 Louis-Nicholas Vauquelin (FR)
Der Name Chrom leitet sich Wortherkunft von griechischem chroma (Farbe); die Salze von Chrom haben viele verschiedene Farben und werden oft als Pigmente in Farben und Lacke verwendet. Chrom ist ein silberweiß glänzendes, sprödes, hartes Schwermetall, das in höchster Reinheit jedoch dehn- und verformbar ist. An der Luft und gegen Wasser ist Chrom beständig. Das Element kommt in der Natur mit Ausnahme von Meteoriten nicht elementar vor. Reines Chrom wird auf elektrolytischem Wege hergestellt, kohlenstoffhaltige Ferrochromlegierungen werden durch Reduktion von Chromit mit Kohle im elektrischen Ofen gewonnen. Chrom ist das wichtigste Legierungsmetall zur Herstellung von nichtrostenden Chromstählen.
| Dichte / g dm-3: | 7190 | (293 K) |
| 6460 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 7.23 | (293 K) |
| 8.05 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 12.9 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 93.7 |
| Schmelzpunkt / °C: | 1907 |
| Siedepunkt / °C: | 2671 |
| Bildungsenergie / kJ mol-1: | 15.3 |
| Verdampfungsenergie / kJ mol-1: | 341.8 |
| Zerstäubungsenergie / kJ mol-1: | 394.51 |
| Erste ionisierungenergie / kJ mol-1: | 652.87 |
| Zweite ionisierungenergie / kJ mol-1: | 1590.64 |
| Dritte ionisierungenergie / kJ mol-1: | 2987.21 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 185 |
| in den Ozeanen / ppm: | 0.00005 |
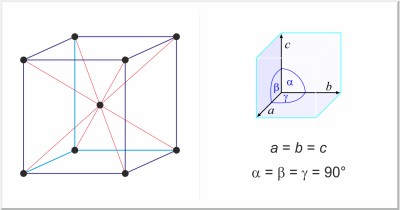
| Kristallstruktur: | kubisch-raumzentriert |
| Gitterparameter der Elementarzelle / pm: | a=288.46 |
| Raumgruppe: | Im3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 50Cr | 49.946050(1) | 4.345(13) |
| 52Cr | 51.940512(2) | 83.789(18) |
| 53Cr | 52.940654(2) | 9.501(17) |
| 54Cr | 53.938885(1) | 2.365(7) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Cr3+ + e- → Cr2+ | - 0.408 | |
| Cr3+ + 3e- → Cr(s) | - 0.744 | |
| Cr2+ + 2e- → Cr(s) | - 0.91 | |
| Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O | +1.33 | |
| Cr2O72- + 12H+ + 6e- → 2CrOH2+ + 5H2O | +1.26 | |
| Cr2O72- + 10H+ + 6e- → 2Cr(OH)2+ + 3H2O | +1.14 | |
| Cr2O72- + 14H+ + 12e- → 2Cr(s) + 7H2O | +0.29 | |
| HCrO4- + 7H+ + 3e- → Cr3+ + 4H2O | +1.20 | |
| CrO42- + 4H2O + 3e- → Cr(OH)3(s) + 5OH- | - 0.13 | |
| HCrO4- + 6H+ + 3e- → CrOH2+ + 3H2O | +1.28 | |
| CrO42- + 7H+ + 3e- → CrOH2+ + 3H2O | +1.40 | |
| CrO42- + 6H+ + 3e- → Cr(OH)2+ + 2H2O | +1.28 | |
| CrO42- + 4H+ + 3e- → CrO2- + 2H2O | +0.95 | |
| CrO42- + 2H+ + 3e- → CrO33- + H2O | +0.36 |
| 23 Vanadium | ← | 24 Chrom | → | 25 Mangan |
Zitieren dieser Seite:
Generalic, Eni. "Chrom." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/cr.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
