IRIDIUM
UEBERGANGSELEMENTE: KOBALTGRUPPE
| Ordnungszahl: | 77 |
| Elementgruppen: | 9 |
| Perioden: | 6 |
| Elektronenkonfiguration: | [Xe] 4f14 5d7 6s2 |
| Oxidationszustände: | +3 +4 |
| Elekronegativität: | 2.2 |
| Atomradius / pm: | 135.7 |
| Relative atommasse: | 192.217(3) |
Endeckung:1803 Smithson Tennant (GB)
Das Iridium wurde nach dem lateinischen Wort für Regenbogen (iris) benannt, da die Iridiumsalze eine große Farbenvielfalt besitzen. Es ist ein silberweiß glänzendes Edelmetall von großer Härte und Sprödigkeit. In der Natur kommt es stets zusammen mit den anderen Platinmetallen. Iridium fällt zusammen mit den anderen Platinmetallen bei der Platinherstellung an. Platin-Iridium-Legierungen mit 20-30% Iridiumanteil werden aufgrund ihrer großen Härte und Korrosionsbeständigkeit in Spitzen von Füllfederhaltern, in Injektionsnadeln, in chirurgischen Instrumenten, in Labortiegeln, in elektrischen Schaltkontakten.
| Dichte / g dm-3: | 22420 | (290 K) |
| 20000 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 8.57 | (290 K) |
| 8.74 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 5.3 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 147 |
| Schmelzpunkt / °C: | 2446 |
| Siedepunkt / °C: | 4428 |
| Bildungsenergie / kJ mol-1: | 26.4 |
| Verdampfungsenergie / kJ mol-1: | 612.1 |
| Zerstäubungsenergie / kJ mol-1: | 664.34 |
| Erste ionisierungenergie / kJ mol-1: | 865.19 |
| Zweite ionisierungenergie / kJ mol-1: | - |
| Dritte ionisierungenergie / kJ mol-1: | - |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.0001 |
| in den Ozeanen / ppm: | - |
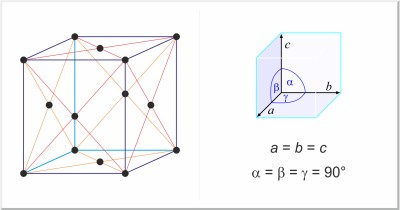
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=383.92 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 191Ir | 190.960591(3) | 37.3(5) |
| 193Ir | 192.962924(3) | 62.7(5) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Ir3+ + 3e- → Ir(s) | +1.15 | |
| IrCl62- + e- → IrCl63- | +1.026 | |
| IrCl62- + 4e- → Ir(s) + 6Cl- | +0.835 | |
| IrCl63- + 3e- → Ir(s) + 6Cl- | +0.77 | |
| IrO2(s) + 4H+ + 4e- → Ir(s) + H2O | +0.93 | |
| IrO2(s) + 2H2O + 4e- → Ir(s) + 4OH- | +0.1 | |
| Ir2O3 + 3H2O + 6e- → 2Ir(s) + 6OH- | +0.1 |
Zitieren dieser Seite:
Generalic, Eni. "Iridium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/ir.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
