RHODIUM
UEBERGANGSELEMENTE: KOBALTGRUPPE
| Ordnungszahl: | 45 |
| Elementgruppen: | 9 |
| Perioden: | 5 |
| Elektronenkonfiguration: | [Kr] 4d8 5s1 |
| Oxidationszustände: | +3 |
| Elekronegativität: | 2.28 |
| Atomradius / pm: | 134.5 |
| Relative atommasse: | 102.905 50(2) |
Endeckung:1803 William Hyde Wollaston (GB)
Der Name Rhodium stammt von dem griechischem Wort für rosenrot, da die wässrigen Lösungen der Rhodiumsalze rosenrot sind. Rhodium ist ein silberweiß glänzendes Metall, das härter als Gold, Silber oder Platin, aber nicht ganz so hart wie Iridium ist. Rhodium kommt in der Natur gediegen und stets vergesellschaftet mit den anderen Platinmetallen vor. Nach der Behandlung des Rohplatins mit Königswasser gehen Platin und Palladium in Lösung während die anderen Platinmetalle im unlöslichen Rückstand verbleiben. Der Großteil des Rhodiums dient zur Herstellung des Platin-Rhodium-Katalysators für die Salpetersäuregewinnung nach dem Ostwald-Verfahren. Ferner dient es in Form von Platin-Rhodium-Legierungen zur Herstellung spezieller Laborgeräte, Spinndüsen und Thermoelemente.
| Dichte / g dm-3: | 12410 | (293 K) |
| 10650 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 8.29 | (293 K) |
| 9.66 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 4.51 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 150 |
| Schmelzpunkt / °C: | 1964 |
| Siedepunkt / °C: | 3695 |
| Bildungsenergie / kJ mol-1: | 21.55 |
| Verdampfungsenergie / kJ mol-1: | 494.34 |
| Zerstäubungsenergie / kJ mol-1: | 555.59 |
| Erste ionisierungenergie / kJ mol-1: | 719.68 |
| Zweite ionisierungenergie / kJ mol-1: | 1744.47 |
| Dritte ionisierungenergie / kJ mol-1: | 2996.86 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 0.005 |
| in den Ozeanen / ppm: | 1E-10 |
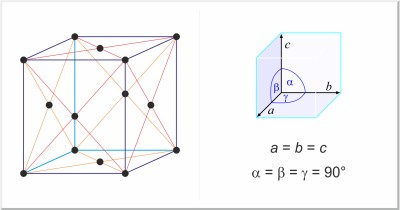
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=380.36 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 103Rh | 102.905504(3) | 100 |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Rh3+ + 3e- → Rh(s) | +0.8 | |
| RhCl63- + 3e- → Rh(s) + 6Cl- | +0.44 | |
| Rh2O3(s) + 6H+ + 6e- → 2Rh(s) + 3H2O | +0.87 | |
| RhO2 + 4H+ + 6Cl- + e- → RhCl63- + 2H2O | +1.4 | |
| RhO2+ + 2H+ + e- → Rh3+ + H2O | +1.40 | |
| RhO42- + 6H+ + 2e- → RhO2+ + 3H2O | +1.46 |
| 44 Ruthenium | ← | 45 Rhodium | → | 46 Palladium |
Zitieren dieser Seite:
Generalic, Eni. "Rhodium." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/rh.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
