ARSÉNICO
GRUPO DEL NITRÓGENIO
| Número atómico: | 33 |
| Grupo: | 15 |
| Periodo: | 4 |
| Configuración electrónica: | [Ar] 3d10 4s2 4p3 |
| Estados de oxidación: | -3 +3 +5 |
| Electronegatividad: | 2.18 |
| Radio atómico / pm: | 124.5 |
| Masa atómica relativa: | 74.921 595(6) |
El arsénico se descubrió por el químico alemán Alberto Magno en 1250. Su nombre procede del griego arsenikos, varonil, macho o de 'arsenikon', el nombre griego del auripigmento, mineral que contiene arsénico. Se presenta en varias formas alotrópicas de las cuales las más importantes son el arsénico gris, de aspecto metálico, blando, frágil y buen conductor del calor, y el arsénico amarillo, no metálico. Tanto él, como sus sales solubles, son tóxicos. Se menudo están asociados con minerales de sulfuros, en especial los de cobre, plomo y plata. Se utiliza para la fabricación de aleaciones con el plomo y el cobre, en agricultura como insecticida (fungicida).
| Densidad / g dm-3: | 5780 | (alfa, 293 K) |
| 4700 | (beta, 293 K) | |
| Volumen molar / cm3mol-1: | 12.96 | (alfa, 293 K) |
| 15.94 | (beta, 293 K) | |
| Resistencia eléctrica / µΩcm: | 33.3 | (20 °C) |
| Conductividad térmica / W m-1K-1: | 50 |
| Punto de fusión / °C: | 817 |
| Punto de ebullición / °C: | 614 |
| Calor de fusión / kJ mol-1: | 27.7 |
| Calor de vaporización / kJ mol-1: | 31.9 |
| Calor de atomización / kJ mol-1: | 301.42 |
| Primera energía de ionización / kJ mol-1: | 944.46 |
| Segunda energía de ionización / kJ mol-1: | 1797.82 |
| Tercera energía de ionización / kJ mol-1: | 2735.48 |
| en la atmósfera / ppm: | - |
| en la corteza terrestre / ppm: | 1 |
| en los océanos / ppm: | 0.003 |
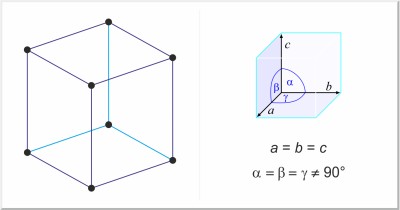
| Estructura cristalina: | romboédrica |
| Dimensiones de la celda unidad / pm: | a=413.18, α=54°10' |
| Grupo espacial: | R3m |
| Isótopo | Masa atómica relativa | Porcentaje por masa (%) |
|---|---|---|
| 75As | 74.921596(2) | 100 |
| Semirreacción | Eo / V | |
|---|---|---|
| H3AsO4 + 3H+ + 2e- → AsO+ + 3H2O | +0.55 | |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.559 | |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.577 | (1 mol dm-3 HCl) |
| H3AsO4 + 2H+ + 2e- → H3AsO3 + H2O | +0.577 | (1 mol dm-3 HClO4) |
| H2AsO4- + 3H+ + 2e- → H3AsO3 + H2O | +0.666 | |
| HAsO42- + 4H+ + 2e- → H3AsO3 + H2O | +0.881 | |
| HAsO42- + 3H+ + 2e- → H2AsO3- + H2O | +0.609 | |
| AsO43- + 3H2O + 2e- → H2AsO3- + 4OH- | - 0.67 | |
| 2H3AsO4 + 4H+ + 4e- → As2O3(s) + 5H2O | +0.58 | |
| 2H2AsO4- + 6H+ + 4e- → As2O3(s) + 5H2O | +0.687 | |
| 2HAsO42- + 8H+ + 4e- → As2O3(s) + 5H2O | +0.901 | |
| 2AsO43- + 10H+ + 4e- → As2O3(s) + 5H2O | +1.27 | |
| AsO43- + 8H+ + 5e- → As(s) + 4H2O | +0.648 | |
| As2O3(s) + 6H+ + 6e- → 2As(s) + 3H2O | +0.234 | |
| AsO+ + 2H+ + 3e- → As(s) + H2O | +0.254 | |
| H3AsO3 + 3H+ + 3e- → As(s) + 3H2O | +0.248 | |
| H2AsO3- + 4H+ + 3e- → As(s) + 3H2O | +0.429 | |
| H2AsO3- + H2O + 3e- → As(s) + 4OH- | - 0.68 | |
| As(s) + 3H+ + 3e- → AsH3(g) | - 0.608 |
| 32 Germanio | ← | 33 Arsénico | → | 34 Selenio |
Citación de esta página:
Generalic, Eni. "Arsénico." EniG. Tabla periódica de los elementos. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/es/as.html>.
Tablas y artículos
- Tabla periódica
- Calculadoras online
- Calculadora científica para química
- Calculadora con leyes de los gases
- Calculadora de masa molar
- Convertir ángulo
- Convertidor números romanos
- Sistema de numeración convertidor
- Preparación de las soluciones
- Etiquetado de envases químicos
- Calculadora de números de oxidacion
- ARS metodo
- Método del número de oxidación
- Método del ion-electrón
- Método de eliminación de Gauss
- Juego de memoria
- Encuentre los pares
- Tablas y artículos
- Química
- Lista de acrónimos y abreviaturas
- Sistemas cristalinos y redes de Bravais
- SGA - Pictogramas de peligro
- Diamante de peligro de NFPA 704
- Constantes físicas fundamentales
- Constantes del producto de solubilidad
- SI - Sistema Internacional de Unidades
- Composición de mezclas y soluciones
- Cálculo estequiométrico
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ecología
- Diseño web
- Diccionario de química (inglés-croata)
- Química
- Descargas
- ≡ Menú
