ÉTAIN
GROUPE du CARBONE
| Nombre atomique: | 50 |
| Groupe: | 14 |
| Période: | 5 |
| Configuration électronique: | [Kr] 4d10 5s2 5p2 |
| Nombre d'oxydation: | +2 +4 |
| Électronégativité: | 1.96 |
| Rayon atomique / pm: | 140.5 |
| Masse atomique relatives: | 118.710(7) |
Ce métal est utilisé depuis l'âge du bronze. Étymologie du nom: vient du latin stannum. On parle par exemple de chlorure stannique. L'étain est un métal gris-argenté, mou, malléable et ductile. Sur les surfaces en contact avec l'air il se forme un film d'oxyde. Il ne réagit ni avec l'oxygène, ni avec l'eau. Il réagit avec les acides et les bases. Les dérivés organiques de l'étain peuvent être très toxiques. On trouve de l'étain principalement dans la cassitérite (SnO2) et la stannite (Cu2FeSnS4). L'étain est utilisé comme revêtement protecteur des cannettes puisqu'il est non-toxique et non-corrosif. Il est employé également pour les soudures (33%Sn:67%Pb), le bronze (20%Sn:80%Cu) et les objets en étain. Le fluorure d'étain (SnF2) est utilisé dans certaines pâtes dentifrice.
| Densité / g dm-3: | 5750 | (alpha, 273 K) |
| 7310 | (bêta, 273 K) | |
| 6973 | (m.p.) | |
| Volume molaire / cm3mol-1: | 20.65 | (alpha, 273 K) |
| 16.24 | (bêta, 273 K) | |
| 17.02 | (m.p.) | |
| Résistivité électrique / µΩcm: | 11 | (20 °C) |
| Conductibilité thermique / W m-1K-1: | 66.6 |
| Point de fusion / °C: | 231.928 |
| Point d'ébullition / °C: | 2602 |
| Enthalpie de fusion / kJ mol-1: | 7.2 |
| Enthalpie d'évaporation / kJ mol-1: | 296.2 |
| Chaleur d'atomisation / kJ mol-1: | 302 |
| Energie de première ionisation / kJ mol-1: | 708.58 |
| Energie de deuxième ionisation / kJ mol-1: | 1411.81 |
| Energie de troisième ionisation / kJ mol-1: | 2943.07 |
| dans l'atmosphère / ppm: | - |
| dans la croute terrestre / ppm: | 2.5 |
| dans les océans / ppm: | 0.003 |
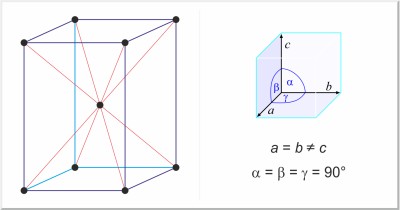
| Structure cristalline: | tétragonal centré |
| Dimension de la cellule unitaire / pm: | a=583.16, c=318.13 |
| Groupe d'espace: | I42/amd |
| Isotope | Masse atomique relatives | Pourcentage massique (%) |
|---|---|---|
| 112Sn | 111.904821(5) | 0.97(1) |
| 114Sn | 113.902782(3) | 0.65(1) |
| 115Sn | 114.903346(3) | 0.34(1) |
| 116Sn | 115.901744(3) | 14.53(1) |
| 117Sn | 116.902954(3) | 7.68(7) |
| 118Sn | 117.901606(3) | 24.23(11) |
| 119Sn | 118.903309(3) | 8.59(4) |
| 120Sn | 119.902197(3) | 32.59(10) |
| 122Sn | 121.903440(3) | 4.63(3) |
| 124Sn | 123.905275(1) | 5.79(5) |
| Demi-réaction | Eo / V | |
|---|---|---|
| Sn4+ + 2e- → Sn2+ | +0.154 | |
| Sn4+ + 2e- → Sn2+ | +0.14 | (1 mol dm-3 HCl) |
| Sn4+ + 4e- → Sn(s) | +0.01 | |
| Sn2+ + 2e- → Sn(s) | - 0.136 | |
| Sn2+ + 2e- → Sn(s) | - 0.16 | (1 mol dm-3 HClO4) |
| SnO32- + 3H+ + 2e- → HSnO2- + H2O | +0.374 | |
| SnO32- + 6H+ + 2e- → Sn2+ + 3H2O | +0.844 | |
| HSnO2- + 3H+ + 2e- → Sn(s) + 2H2O | +0.333 | |
| Sn(s) + 4H+ + 4e- → SnH4(g) | - 1.074 |
| 49 Indium | ← | 50 Etain | → | 51 Antimoine |
Citation de cette page:
Generalic, Eni. "Étain." EniG. Tableau périodique des éléments. KTF-Split, 13 Feb. 2025. Web. 13 Apr. 2025. <https://www.periodni.com/fr/sn.html>.
Tableaux et articles
- Tableau périodique
- Home
- Forme courte du tableau périodique
- Forme longue du tableau périodique
- History of the Periodic table of elements
- Impression du tableau périodique
- Configuration électronique des éléments
- Liste alphabétique des éléments chimiques
- Naming of elements of atomic numbers greater than 100
- ASCII Tableau périodique
- Calculatrices online
- Calculatrice scientifique pour chimiste
- Calculatrice lois de gaz
- Calculateur de masse molaire
- Convertir angle
- Convertisseur chiffres romains
- Convertisseur systèmes numériques
- Préparation des solutions
- Étiquetage des conteneurs chimiques
- Calculateur de nombres d'oxydation
- ARS methode
- Méthode du changement des nombres d'oxydation
- Méthode ions-électrons
- Méthode d'élimination de Gauss
- Jeu de mémoire
- Trouvez les paires
- Tableaux et articles
- Chimie
- Liste des abréviations et acronymes
- Systèmes cristallins et réseaux de Bravais
- SGH - Pictogrammes de danger
- NFPA 704 feu diamant
- Constantes physiques fondamentales
- Constantes du produit de solubilité
- SI - Système international d'unités
- Composition des melanges et des solutions
- Calcul stœchiométrique
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Écologie
- Web design
- Dictionnaire de chimie (anglais-croate)
- Chimie
- Télécharger
- ≡ Menu
