KUPFER
UEBERGANGSELEMENTE: KUPFERGRUPPE
| Ordnungszahl: | 29 |
| Elementgruppen: | 11 |
| Perioden: | 4 |
| Elektronenkonfiguration: | [Ar] 3d10 4s1 |
| Oxidationszustände: | +1 +2 |
| Elekronegativität: | 1.9 |
| Atomradius / pm: | 127.8 |
| Relative atommasse: | 63.546(3) |
Endeckung:- -
Das Elementsymbol Cu stammt von dem lateinischen aes cuprium, das zyprische Erz. Kupfer ist ein hellrotes, relativ weich und gut schmiedbares Schwermetall. Es ist, nach Silber, der beste Strom- und Wärmeleiter. In feuchter Luft überzieht sich das glänzend hellrote Kupfer mit einer grünen Schicht von basischem Kupfercarbonat (Patina). Wegen seiner guten elektrischen Leitfähigkeit wird es zu Drähten und Stromschienen verarbeitet. Aufgrund seiner Korrosionsbeständigkeit gelangt es als Baumaterial für Dachbleche und Dachrinnen, aber auch im Maschinen- und Apparatebau, für Beschläge, für Patronenhülsen oder für Münzen zum Einsatz.
| Dichte / g dm-3: | 8960 | (293 K) |
| 7940 | (m.p.) | |
| Atomvolumen / cm3mol-1: | 7.09 | (293 K) |
| 8.00 | (m.p.) | |
| Elektrische widerstandskraft / µΩcm: | 1.673 | (20 °C) |
| Wärmeleitfähigkeit / W m-1K-1: | 401 |
| Schmelzpunkt / °C: | 1084.62 |
| Siedepunkt / °C: | 2562 |
| Bildungsenergie / kJ mol-1: | 13 |
| Verdampfungsenergie / kJ mol-1: | 306.7 |
| Zerstäubungsenergie / kJ mol-1: | 337.15 |
| Erste ionisierungenergie / kJ mol-1: | 745.49 |
| Zweite ionisierungenergie / kJ mol-1: | 1957.93 |
| Dritte ionisierungenergie / kJ mol-1: | 3554.64 |
| in der Atmosphäre / ppm: | - |
| in der Erdkruste / ppm: | 75 |
| in den Ozeanen / ppm: | 0.003 |
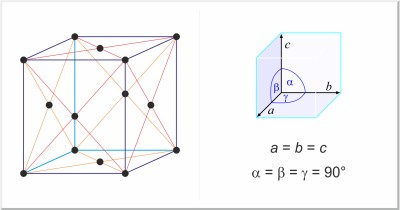
| Kristallstruktur: | kubisch-flächenzentriert |
| Gitterparameter der Elementarzelle / pm: | a=361.47 |
| Raumgruppe: | Fm3m |
| Isotopen | Relative atommasse | Massenanteil (%) |
|---|---|---|
| 63Cu | 62.929601(2) | 69.17(3) |
| 65Cu | 64.927794(2) | 30.83(3) |
| Ausgeglichene halbreaktion | Eo / V | |
|---|---|---|
| Cu2+ + 2e- → Cu(s) | +0.337 | |
| Cu2+ + e- → Cu+ | +0.153 | |
| Cu+ + e- → Cu(s) | +0.521 | |
| HCuO2- + 3H+ + e- → Cu+ + 2H2O | +1.73 | |
| CuO22- + 4H+ + e- → Cu+ + 2H2O | +2.51 | |
| HCuO2- + 3H+ + 2e- → Cu(s) + 2H2O | +1.13 | |
| CuO22- + 4H+ + 2e- → Cu(s) + 2H2O | +1.52 | |
| 2Cu2+ + H2O + 2e- → Cu2O(s) + 2H+ | +0.20 | |
| 2HCuO2- + 4H+ + 2e- → Cu2O(s) + 3H2O | +1.78 | |
| 2CuO22- + 6H+ + 2e- → Cu2O(s) + 3H2O | +2.56 | |
| CuO + 2H+ + e- → Cu+ + H2O | +0.62 | |
| Cu2+ + Br- + e- → CuBr(s) | +0.64 | |
| Cu2+ + Cl- + e- → CuCl(s) | +0.54 | |
| Cu2+ + I- + e- → CuI(s) | +0.86 | |
| CuI(s) + e- → Cu(s) + I- | - 0.185 | |
| Cu(NH3)42+ + e- → Cu(NH3)2+ + 2NH3 | - 0.01 | |
| Cu(NH3)2+ + e- → Cu(s) + 2NH3 | - 0.12 | |
| Cu(NH3)42+ + 2e- → Cu(s) + 4NH3 | - 0.07 |
Zitieren dieser Seite:
Generalic, Eni. "Kupfer." EniG. Periodensystem der Elemente. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/de/cu.html>.
Tabellen und Artikel
- Periodensystem
- Online-Taschenrechner
- Wissenschaftlicher Rechner für Chemiker
- Gasgesetzen Rechner
- Molmassenrechner
- Winkelkonverter
- Römische Zahlen umwandeln
- Numerische Systeme konvertieren
- Herstellung von Lösungen
- Kennzeichnung von Chemikalienbehältern
- Oxidationszahlen Rechner
- ARS methode
- Oxidationszahlmethode
- Ionen-Elektronen-Methode
- Eliminationsmethode von Gauss
- Memory-Spiel
- Paare finden
- Tabellen und Artikel
- Chemie
- Liste mit Akronyme und Abkürzungen
- Kristallsysteme und Bravais-Gitter
- GHS - Gefahrenpiktogramme
- NFPA 704 Gefahrendiamant
- Fundamentale Physikalische Konstanten
- Löslichkeitsprodukt-Konstante
- SI - Internationale Einheitensystem
- Zusammensetzung von Mischungen und Lösungen
- Stöchiometrische Rechnung
- Chlorinity and salinity of seawater
- Rare earth elements (REE)
- Ökologie
- Webdesign
- Chemiewörterbuch (Englisch-Kroatisch)
- Chemie
- Downloads
- ≡ Menü
