BROMO
ALOGENI ELEMENTI
| Numero atomico: | 35 |
| Gruppo: | 17 |
| Periodo: | 4 |
| Configurazione elettronica: | [Ar] 3d10 4s2 4p5 |
| Numeri di ossidazione: | -1 +1 +5 |
| Elettronegatività: | 2.96 |
| Raggio atomico / pm: | 114.5 |
| Massa atomica relativa: | [79.901, 79.907] |
Scopritore:1826 Antoine-Jérôme Balard (FR)
Il bromo deriva dal Greco bromos (puzza, fetore). Infatti il bromo a temperatura e pressione ambiente è un liquido rosso-bruno di odore sgradevole e soffocante. E' solubile in acqua e vaporizza facilmente. E' l'unico nonmetallo liquido a temperatura ambiente. Si ottiene per via elettrolitica dal bromuro di sodio presente nell'acqua di mare. Usato nell'industria chimica, ad es. per la preparazione del dibromoetilene, come additivo delle benzine, in medicina e, come bromuro di argento nell'industria fotografica.
| Densità / g dm-3: | 4050 | (123 K) |
| 3122.6 | (293 K) | |
| 7.59 | (gas, 273 K) | |
| Volume atomico / cm3mol-1: | 19.73 | (123 K) |
| 25.59 | (293 K) | |
| 21055.07 | (gas, 273 K) | |
| Resistività Elettrica / µΩcm: | - | (20 °C) |
| Conducibilità termica / W m-1K-1: | 0.0047 |
| Temperatura di fusione / °C: | -7.2 |
| Temperatura di ebollizione / °C: | 58.78 |
| Calore di fusione / kJ mol-1: | 10.8 |
| Calore di vaporizzazione / kJ mol-1: | 30.5 |
| Calore di atomizzazione / kJ mol-1: | 117.943 |
| Energia di prima ionizzazione / kJ mol-1: | 1139.87 |
| Energia di seconda ionizzazione / kJ mol-1: | 2103.40 |
| Energia di terza ionizzazione / kJ mol-1: | 3473.50 |
| nell'atmosfera / ppm: | - |
| nella crosta terrestre / ppm: | 2.5 |
| negli oceani / ppm: | 65 |
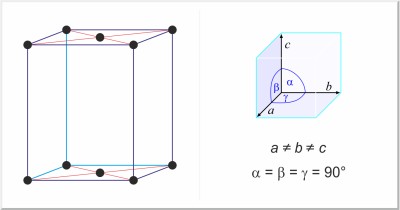
| Struttura cristallina: | ortorombico a base centrata |
| Dimensioni della cella unitaria / pm: | a=673.7, b=454.8, c=876.1 |
| Gruppo spaziale: | Cmca |
| Isotopo | Massa atomica relativa | Percentuale in peso (%) |
|---|---|---|
| 79Br | 78.918338(2) | 50.69(7) |
| 81Br | 80.916291(3) | 49.31(7) |
| Bilanciamento della semireazione | Eo / V | |
|---|---|---|
| Br2(l) + 2e- → 2Br- | +1.065 | |
| Br2(aq) + 2e- → 2Br- | +1.087 | |
| Br3- + 2e- → 3Br- | +1.05 | |
| HBrO3 + 5H+ + 6e- → Br- + 3H2O | +1.42 | |
| 3HBrO3 + 15H+ + 16e- → Br3- + 9H2O | +1.462 | |
| 2BrO3- + 12H+ + 10e- → Br2(l) + 6H2O | +1.52 | |
| BrO3- + 6H+ + 6e- → Br- + 3H2O | +1.44 | |
| BrO3- + 3H2O + 6e- → Br- + 6OH- | +0.61 | |
| 2HBrO2 + 10H+ + 10e- → Br2(l) + 6H2O | +1.48 | |
| HBrO3 + 4H+ + 4e- → HBrO + 2H2O | +1.46 | |
| HBrO3 + 3H+ + 4e- → BrO- + 2H2O | +1.33 | |
| 2HBrO + 2H+ + 2e- → Br2(l) + 2H2O | +1.59 | |
| 2BrO- + 4H+ + 2e- → Br2(l) + 2H2O | +2.09 | |
| 2BrO- + 2H2O + 2e- → Br2(l) + 4OH- | +0.45 | |
| BrO- + H2O + 2e- → Br- + 2OH- | +0.76 |
| 34 Selenio | ← | 35 Bromo | → | 36 Cripto |
Citazione della questa pagina:
Generalic, Eni. "Bromo." EniG. Tavola periodica degli elementi. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/it/br.html>.
Tavoli e articoli
- Tavola periodica
- Home
- Forma breve della tavola periodica
- Forma lunga della tavola periodica
- History of the Periodic table of elements
- Tavola periodica stampabile
- Configurazione elettronica degli elementi
- Elenco alfabetico degli elementi chimici
- Naming of elements of atomic numbers greater than 100
- ASCII Tavola periodica
- Calcolatrici online
- Calcolatrice scientifica per i chimici
- Calcolatrice di leggi dei gas
- Calcolatore della massa molare
- Convertitore angolo
- Convertitore di numeri romani
- Convertitore sistemi numerazione
- Preparazione delle soluzioni
- Etichettatura dei contenitori chimici
- Calcolatrice numeri di ossidazione
- ARS metodo
- Metodo della variazione del numero di ossidazione
- Metodo ione-elettrone
- Metodo di eliminazione di Gauss
- Gioco di memoria
- Trova le coppie
- Tabelle e articoli
- Chimica
- Lista di abbreviazioni e acronimi
- Sistemi cristallini e reticoli di Bravais
- GHS - Pittogrammi di pericolo
- Diamante di fuoco di NFPA 704
- Costanti fisiche fondamentali
- Costanti del prodotto di solubilità
- SI - Unità del Sistema Internazionale
- Composizione delle miscele e soluzioni
- Calcolo stechiometrico
- Chlorinity and salinity of seawater
- Elementi di terre rare (REE)
- Ecologia
- Web design
- Dizionario di chimica (inglese-croato)
- Chimica
- Scaricare
- ≡ Menu
