Te
Tellurium
TELLURIO
CALCOGENI ELEMENTI
| Numero atomico: | 52 |
| Gruppo: | 16 |
| Periodo: | 5 |
| Configurazione elettronica: | [Kr] 4d10 5s2 5p4 |
| Numeri di ossidazione: | -2 +4 +6 |
| Elettronegatività: | 2.1 |
| Raggio atomico / pm: | 143.2 |
| Massa atomica relativa: | 127.60(3) |
Scopritore:1782 Franz Joseph Muller von Reichstein (AT)
Il tellurio deriva dal Greco tellus (la Terra). Esso è un metalloide con aspetto metallico bianco-argenteo. Si ottiene come sottoprodotto della raffinazione di rame e piombo. Usato in leghe per acciai speciali o con il rame. Utilizzato nell'industria della gomma e per colorare vetri e ceramiche.
| Densità / g dm-3: | 6240 | (293 K) |
| 5797 | (m.p.) | |
| Volume atomico / cm3mol-1: | 20.45 | (293 K) |
| 22.01 | (m.p.) | |
| Resistività Elettrica / µΩcm: | 436000 | (20 °C) |
| Conducibilità termica / W m-1K-1: | 2.35 |
| Temperatura di fusione / °C: | 449.51 |
| Temperatura di ebollizione / °C: | 988 |
| Calore di fusione / kJ mol-1: | 13.5 |
| Calore di vaporizzazione / kJ mol-1: | 104.6 |
| Calore di atomizzazione / kJ mol-1: | - |
| Energia di prima ionizzazione / kJ mol-1: | 869.30 |
| Energia di seconda ionizzazione / kJ mol-1: | 1794.64 |
| Energia di terza ionizzazione / kJ mol-1: | 2697.75 |
| nell'atmosfera / ppm: | - |
| nella crosta terrestre / ppm: | 0.01 |
| negli oceani / ppm: | - |
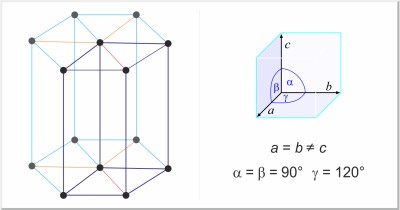
| Struttura cristallina: | esagonale |
| Dimensioni della cella unitaria / pm: | a=445.65, c=592.68 |
| Gruppo spaziale: | P3121 |
| Isotopo | Massa atomica relativa | Percentuale in peso (%) |
|---|---|---|
| 120Te | 119.90402(1) | 0.096(2) |
| 122Te | 121.903047(2) | 2.603(4) |
| 123Te | 122.904273(2) | 0.908(2) |
| 124Te | 123.902819(2) | 4.816(6) |
| 125Te | 124.904425(2) | 7.139(6) |
| 126Te | 125.903306(2) | 18.95(1) |
| 128Te | 127.904461(2) | 31.69(1) |
| 130Te | 129.906223(2) | 33.80(1) |
| Bilanciamento della semireazione | Eo / V | |
|---|---|---|
| Te4+ + 4e- → Te(s) | +0.568 | |
| Te4+ + 2H+ + 6e- → H2Te(g) | +0.132 | |
| TeO42- + 4H+ + 2e- → TeO2(s) + 2H2O | +1.509 | |
| HTeO4- + 3H+ + 2e- → TeO2(s) + 2H2O | +1.202 | |
| H2TeO4 + 2H+ + 2e- → TeO2(s) + 2H2O | +1.020 | |
| TeO42- + 2H+ + 2e- → TeO32- + H2O | +0.892 | |
| HTeO4- + H+ + 2e- → TeO32- + H2O | +0.584 | |
| HTeO4- + 2H+ + 2e- → HTeO3- + H2O | +0.813 | |
| H2TeO4 + H+ + 2e- → HTeO3- + H2O | +0.631 | |
| H2TeO4 + 3H+ + 2e- → HTeO2+ + 2H2O | +0.953 | |
| H2TeO4 + 6H+ + 2e- → Te4+ + 4H2O | +0.920 | |
| Te(OH)6(s) + 2H+ + 2e- → TeO2(s) + 4H2O | +1.02 | |
| TeO32- + 6H+ + 4e- → Te(s) + 3H2O | +0.827 | |
| HTeO3- + 5H+ + 4e- → Te(s) + 3H2O | +0.713 | |
| HTeO2+ + 3H+ + 4e- → Te(s) + 2H2O | +0.551 | |
| TeO2+ + 5H+ + 6e- → H2Te(g) + 2H2O | +0.121 | |
| Te(s) + 2H+ + 2e- → H2Te(g) | - 0.739 | |
| Te(s) + 2e- → Te2- | - 1.14 |
| 51 Antimonio | ← | 52 Tellurio | → | 53 Iodio |
Citazione della questa pagina:
Generalic, Eni. "Tellurio." EniG. Tavola periodica degli elementi. KTF-Split, 13 Feb. 2025. Web. 30 Mar. 2025. <https://www.periodni.com/it/te.html>.
Tavoli e articoli
- Tavola periodica
- Home
- Forma breve della tavola periodica
- Forma lunga della tavola periodica
- History of the Periodic table of elements
- Tavola periodica stampabile
- Configurazione elettronica degli elementi
- Elenco alfabetico degli elementi chimici
- Naming of elements of atomic numbers greater than 100
- ASCII Tavola periodica
- Calcolatrici online
- Calcolatrice scientifica per i chimici
- Calcolatrice di leggi dei gas
- Calcolatore della massa molare
- Convertitore angolo
- Convertitore di numeri romani
- Convertitore sistemi numerazione
- Preparazione delle soluzioni
- Etichettatura dei contenitori chimici
- Calcolatrice numeri di ossidazione
- ARS metodo
- Metodo della variazione del numero di ossidazione
- Metodo ione-elettrone
- Metodo di eliminazione di Gauss
- Gioco di memoria
- Trova le coppie
- Tabelle e articoli
- Chimica
- Lista di abbreviazioni e acronimi
- Sistemi cristallini e reticoli di Bravais
- GHS - Pittogrammi di pericolo
- Diamante di fuoco di NFPA 704
- Costanti fisiche fondamentali
- Costanti del prodotto di solubilità
- SI - Unità del Sistema Internazionale
- Composizione delle miscele e soluzioni
- Calcolo stechiometrico
- Chlorinity and salinity of seawater
- Elementi di terre rare (REE)
- Ecologia
- Web design
- Dizionario di chimica (inglese-croato)
- Chimica
- Scaricare
- ≡ Menu
Copyright © 1998-2025 by Eni Generalic. Tutti i diritti sono riservati. | Bibliografia | Disclaimer
