SILICIO
CARBONIO GRUPPO
| Numero atomico: | 14 |
| Gruppo: | 14 |
| Periodo: | 3 |
| Configurazione elettronica: | [Ne] 3s2 3p2 |
| Numeri di ossidazione: | -4 +2 +4 |
| Elettronegatività: | 1.9 |
| Raggio atomico / pm: | 117.6 |
| Massa atomica relativa: | [28.084, 28.086] |
Scopritore:1824 Jöns Jacob Berzelius (SE)
Il silicio deriva dal Latino silex (pietra focaia). La forma cristallina ha aspetto metallico grigiastro; la forma amorfa quella di polvere marrone. Settimo elemento più abbondante dell'universo, secondo della crosta terrestre. Il silicio infatti è presente sotto forma di composti praticamente in tutte le rocce. Si ottiene per reazione della silice (SiO2) col carbone a 2200 °C o per estrazione da altri silicati. Il silicio ed i suoi composti sono usati nell'industria vetraria, nell'industria dei semiconduttori ed in quella chimica (siliconi).
| Densità / g dm-3: | 2329 | (293 K) |
| 2525 | (m.p.) | |
| Volume atomico / cm3mol-1: | 12.06 | (293 K) |
| 11.12 | (m.p.) | |
| Resistività Elettrica / µΩcm: | 10 | (20 °C) |
| Conducibilità termica / W m-1K-1: | 148 |
| Temperatura di fusione / °C: | 1414 |
| Temperatura di ebollizione / °C: | 3265 |
| Calore di fusione / kJ mol-1: | 39.6 |
| Calore di vaporizzazione / kJ mol-1: | 383.3 |
| Calore di atomizzazione / kJ mol-1: | 451.29 |
| Energia di prima ionizzazione / kJ mol-1: | 786.52 |
| Energia di seconda ionizzazione / kJ mol-1: | 1577.15 |
| Energia di terza ionizzazione / kJ mol-1: | 3231.61 |
| nell'atmosfera / ppm: | - |
| nella crosta terrestre / ppm: | 267700 |
| negli oceani / ppm: | 3 |
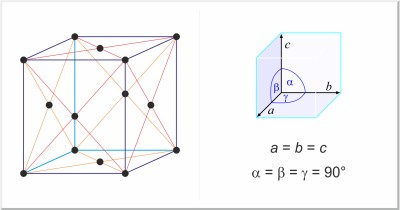
| Struttura cristallina: | cubico a facce centrate |
| Dimensioni della cella unitaria / pm: | a=543.07 |
| Gruppo spaziale: | Fd3m |
| Isotopo | Massa atomica relativa | Percentuale in peso (%) |
|---|---|---|
| 28Si | 27.976926533(2) | 92.23(1) |
| 29Si | 28.97649472(3) | 4.67(1) |
| 30Si | 29.97377022(5) | 3.10(1) |
| Bilanciamento della semireazione | Eo / V | |
|---|---|---|
| SiO2(s) + 4H+ + 4e- → Si(s) + 2H2O | - 0.86 | |
| SiO32- + 6H+ + 4e- → Si(s) + 3H2O | - 0.455 | |
| HSiO3- + 5H+ + 4e- → Si(s) + 3H2O | - 0.632 | |
| H2SiO3 + 4H+ + 4e- → Si(s) + 3H2O | - 0.780 | |
| SiO2(s) + 8H+ + 8e- → SiH4(g) + 2H2O | - 0.377 | |
| SiO32- + 10H+ + 8e- → SiH4(g) + 3H2O | - 0.176 | |
| HSiO3- + 9H+ + 8e- → SiH4(g) + 3H2O | - 0.265 | |
| H2SiO3 + 8H+ + 8e- → SiH4(g) + 3H2O | - 0.339 | |
| Si(s) + 4H+ + 4e- → SiH4(g) | +0.102 | |
| SiF62- + 4e- → Si(s) + 6F- | - 1.2 |
| 13 Alluminio | ← | 14 Silicio | → | 15 Fosforo |
Citazione della questa pagina:
Generalic, Eni. "Silicio." EniG. Tavola periodica degli elementi. KTF-Split, 13 Feb. 2025. Web. 12 Apr. 2025. <https://www.periodni.com/it/si.html>.
Tavoli e articoli
- Tavola periodica
- Home
- Forma breve della tavola periodica
- Forma lunga della tavola periodica
- History of the Periodic table of elements
- Tavola periodica stampabile
- Configurazione elettronica degli elementi
- Elenco alfabetico degli elementi chimici
- Naming of elements of atomic numbers greater than 100
- ASCII Tavola periodica
- Calcolatrici online
- Calcolatrice scientifica per i chimici
- Calcolatrice di leggi dei gas
- Calcolatore della massa molare
- Convertitore angolo
- Convertitore di numeri romani
- Convertitore sistemi numerazione
- Preparazione delle soluzioni
- Etichettatura dei contenitori chimici
- Calcolatrice numeri di ossidazione
- ARS metodo
- Metodo della variazione del numero di ossidazione
- Metodo ione-elettrone
- Metodo di eliminazione di Gauss
- Gioco di memoria
- Trova le coppie
- Tabelle e articoli
- Chimica
- Lista di abbreviazioni e acronimi
- Sistemi cristallini e reticoli di Bravais
- GHS - Pittogrammi di pericolo
- Diamante di fuoco di NFPA 704
- Costanti fisiche fondamentali
- Costanti del prodotto di solubilità
- SI - Unità del Sistema Internazionale
- Composizione delle miscele e soluzioni
- Calcolo stechiometrico
- Chlorinity and salinity of seawater
- Elementi di terre rare (REE)
- Ecologia
- Web design
- Dizionario di chimica (inglese-croato)
- Chimica
- Scaricare
- ≡ Menu
